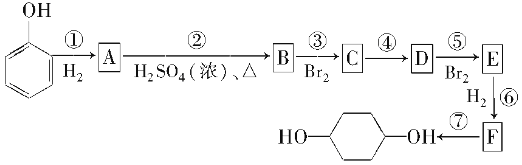
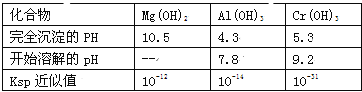
题目内容
【题目】现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:________________________。正极:________________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)。

(3)Cu2+、Fe3+的氧化性由强到弱的顺序为:___________。
(4)该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的物质的量是_________。
【答案】
(1)Cu -2e- = Cu2+,2Fe3+ +2e- =2Fe2+;
(2)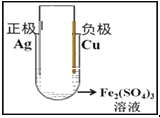 ;
;
(3)Fe3+﹥Cu2+;
(4)0.1 mol。
【解析】
试题分析:(1)验证Cu2+、Fe3+氧化性的强弱,原理是Cu+2Fe3+=Cu2++2Fe2+,根据原电池的工作原理,Cu作负极,其电极反应式为Cu-2e-=Cu2+,纯银片作正极,其反应式为Fe3++e-=Fe2+;(2)电子从负极经外电路流向正极,其装置图为: ;(3)根据总电极反应式,氧化剂的氧化性大于氧化产物的氧化性,Fe3+>Cu2+;(4)溶液增加的量为Cu的质量,根据负极电极反应式,转移电子的物质的量为3.2×2/64mol=0.1mol。
;(3)根据总电极反应式,氧化剂的氧化性大于氧化产物的氧化性,Fe3+>Cu2+;(4)溶液增加的量为Cu的质量,根据负极电极反应式,转移电子的物质的量为3.2×2/64mol=0.1mol。

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |