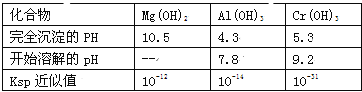
题目内容
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
(1)用铜作阳极,钦片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,有关转化如图所示。

将得到的Cu2O溶于稀硫酸,发现有红色固体生成,该反应中氧化剂与还原剂的质量之比为___________。图中③④两步反应的总反应离子方程式为________________。
(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1;按![]() 的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。
的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。

①图中压强pl、p2、p3由大到小的顺序是_________。
②a _________(填“>”或“<”) 0。
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡,该温度下反应的平衡常数为__________。
【答案】(1)1:1;2CuCl2-+2OH-=Cu2O↓+H2O+4Cl-;
(2)①p1>p2>p3;②<;③46.3L2/mol2(不写单位不扣分)
【解析】
试题分析:(1)将得到的Cu2O溶于稀硫酸,发现有红色固体生成,这说明反应中有铜生成,则反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O,所以氧化亚铜既是氧化剂,也是还原剂,该反应中氧化剂与还原剂的质量之比为1:1;图中③④两步反应的总反应离子方程式为2CuCl2-+2OH-=Cu2O↓+H2O+4Cl-。
(2)①正反应是体积减小的可逆反应,温度相同时压强越大CO的转化率越大,则根据图像可知压强pl、p2、p3由大到小的顺序是p1>p2>p3;
②根据图像可知升高温度CO转化率降低,说明平衡向逆反应方向进行,所以正反应是放热反应;
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡CO的转化率是0.4,即消耗0.04mol/LCO,则根据方程式可知消耗氢气是0.08mol/L,生成甲醇是0.04mol/L,所以该温度下反应的平衡常数为![]() 。
。

【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |