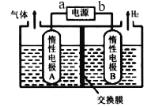
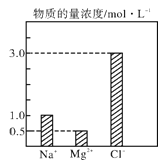
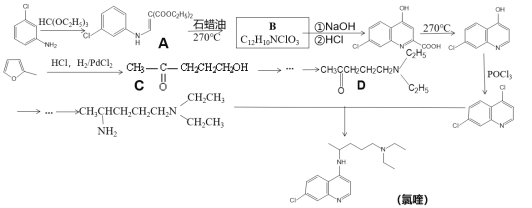
��Ŀ����
����Ŀ��(1)CaCO3��������Ϊ0.90��ʯ��ʯ100 kg��ȫ�ֽ����CO2________L����״����,ʯ��Ҥ�и�ʯ��ʯ100 kg�뽹̿���գ�����CO2 29120 L����״���������ʯ��ʯ��̼�����ȫ�ֽ⣬�ҽ�̿��ȫȼ�գ�������CO����̿������Ϊ__________g
(2)��25�桢101kPa�������£�ͬ������CH4�ͣ���������֮��Ϊ15��8����ص�Ħ��������_______________��
(3)������ͬ������ܱ�����X��Y����25���£�X�г���a gA���壬Y�г���a g CH4���壬X��Y�ڵ�ѹǿ֮����4��11����A��Ħ��������_______________��
���𰸡�20160 4800 30g/mol 44g/mol
��������
(1) n(CaCO3)=![]() ������CaCO3����CO2�����CaCO3��ȫ�ֽ����CO2�������n(CO2)=
������CaCO3����CO2�����CaCO3��ȫ�ֽ����CO2�������n(CO2)=![]() ��n(CaCO3)=900mol����̿ȼ������CO2���ʵ���Ϊ1300mol-900mol=400mol���Ӷ������̿��������
��n(CaCO3)=900mol����̿ȼ������CO2���ʵ���Ϊ1300mol-900mol=400mol���Ӷ������̿��������
(2)���ð����ӵ����ɵ����ۣ���������ʵ���֮�ȵ���������ȣ�����������ϵʽ���Ӷ����X��Ħ��������
(3)���ð����ӵ����ɵ����ۣ���������ʵ���֮�ȵ�����ѹǿ�ȣ�����������ϵʽ���Ӷ����A��Ħ��������
(1) n(CaCO3)=![]() ������CaCO3����CO2�����CaCO3��ȫ�ֽ����CO2�������V=900mol��22.4L/mol= 20160L��
������CaCO3����CO2�����CaCO3��ȫ�ֽ����CO2�������V=900mol��22.4L/mol= 20160L��
n(CO2)=![]() ��n(CaCO3)=900mol����̿ȼ������CO2���ʵ���Ϊ1300mol-900mol=400mol���Ӷ������̿������Ϊ400mol��12g/mol=4800g���ʴ�Ϊ��20160��4800��
��n(CaCO3)=900mol����̿ȼ������CO2���ʵ���Ϊ1300mol-900mol=400mol���Ӷ������̿������Ϊ400mol��12g/mol=4800g���ʴ�Ϊ��20160��4800��
(2)���ð����ӵ����ɵ����ۣ���������ʵ���֮�ȵ����������
�������������Ϊ1g��X��Ħ������ΪM
��![]() ���Ӷ����M=30g/mol���ʴ�Ϊ��30g/mol��
���Ӷ����M=30g/mol���ʴ�Ϊ��30g/mol��
(3)���ð����ӵ����ɵ����ۣ���������ʵ���֮�ȵ�����ѹǿ��
��A��Ħ������Ϊy
��![]() �����y=44g/mol���ʴ�Ϊ��44g/mol��
�����y=44g/mol���ʴ�Ϊ��44g/mol��