ΧβΡΩΡΎ»ί
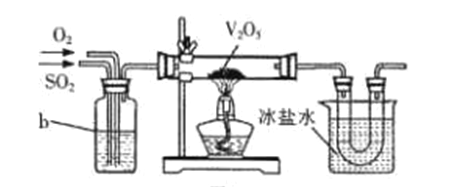
ΓΨΧβΡΩΓΩΟΚΒΡ÷ς“ΣΉι≥…‘ΣΥΊ «ΧΦΓΔ«βΓΔ―θΓΔΝρΓΔΒΣΘ§ΜΙ”–ΦΪ…ΌΝΩΒΡΝΉΓΔ…ιΓΔ’ύΓΔοΊΓΔνςΒ»‘ΣΥΊΘ§ »ΦΟΚ≤ζ…ζCxHyΓΔSO2ΓΔNOXΒ»¥σΤχΈέ»ΨΈοΘ§―–ΨΩNO2ΓΔNOΓΔCOΓΔSO2Β»¥σΤχΈέ»ΨΈοΚΆΥ°Έέ»ΨΈοΒΡ¥ΠάμΕ‘Ϋ®…ηΟάάω÷–ΙζΨΏ”–÷Ί“Σ“β“εΓΘ
(1)’ύ «ΒΎΥΡ÷ήΤΎΒΎΔτA‘ΣΥΊΘ§Τδ‘≠Ή”ΫαΙΙ Ψ“βΆΦΈΣ_______________ΓΘ
(2)άϊ”ΟΟΚΒΡΤχΜ·ΜώΒΟΒΡΥ°ΟΚΤχ(÷ς“Σ≥…Ζ÷ΈΣCOΓΔCO2ΚΆH2)‘Ύ¥ΏΜ·ΦΝΉς”Οœ¬Ω…“‘Κœ≥…¬Χ…Ϊ»ΦΝœΦΉ¥ΦΓΘ
“―÷ΣΘΚH2O(l)=H2O(g) ΓςH1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) ΓςH2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΓςH3=-58.7 kJ/mol
–¥≥ω”…CO”κH2÷Τ±ΗCH3OHΤχΧεΒΡ»»Μ·―ßΖΫ≥Χ Ϋ_________________ΓΘ
(3)ΦΉ¥ΦΚΆCO2Ω…÷±Ϋ”Κœ≥…ΧΦΥαΕΰΦΉθΞ(CH3OCOOCH3Θ§Φρ≥ΤDMC)ΘΚ
2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) ΓςH4<0
CH3OCOOCH3(g)+H2O(g) ΓςH4<0
ΔΌΗΟΜ·―ßΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±μ¥ο ΫΈΣK=________________ΓΘ
ΔΎ‘ΎΚψΈ¬Κψ»ίΟή±’»ίΤς÷–ΖΔ…ζ…œ ωΖ¥”ΠΘ§ΡήΥΒΟςΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ΒΡ «_______(Χν±ξΚ≈)ΓΘ
AΘ°v’ΐ(CH3OH)= 2vΡφ(H2O) BΘ°»ίΤςΡΎΤχΧεΒΡΟήΕ»≤Μ±δ
CΘ°»ίΤςΡΎ―Ι«Ω≤Μ±δ DΘ°CH3OH”κCO2ΒΡΈο÷ ΒΡΝΩ÷°±»±Θ≥÷≤Μ±δ
Δέ“ΜΕ®ΧθΦΰœ¬Ζ÷±πœρΦΉΓΔ““ΓΔ±ϊ»ΐΗωΚψ»ίΟή±’»ίΤς÷–Φ”»κ“ΜΕ®ΝΩΒΡ≥θ ΦΈο÷ ΖΔ…ζΗΟΖ¥”ΠΘ§Ης»ίΤς÷–Έ¬Ε»ΓΔΖ¥”ΠΈοΒΡΤπ ΦΝΩ»γœ¬±μΘ§Ζ¥”ΠΙΐ≥Χ÷–DMCΒΡΈο÷ ΒΡΝΩ≈®Ε»Υφ ±Φδ±δΜ·»γœ¬ΆΦΥυ ΨΘΚ


ΦΉ»ίΤς÷–Θ§‘Ύ5-15min÷–ΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(CO2) =__________ΓΘ““»ίΤς÷–Θ§»τΤΫΚβ ±n(CO2) =0.2molΘ§‘ρT1__________T2(ΧνΓΑ>Γ±ΓΑ<"ΜρΓ±=Γ±)ΓΘΦΉΓΔ±ϊΝΫ»ίΤςΒΡΖ¥”Π¥οΤΫΚβ ±CO2ΒΡΉΣΜ·¬ ΘΚΦΉ__________±ϊ(ΧνΓΑ>Γ±ΓΑ<"ΜρΓ±=Γ±)ΓΘ
(4)÷±Ϋ”≈≈Ζ≈Κ§SO2ΒΡ―ΧΤχΜα–Έ≥…Υα”ξΘ§ΈΘΚΠΜΖΨ≥ΓΘΩ…”ΟNaOHΈϋ ’Θ§ΥυΒΟΚ§ΝρΗςΈΔΝΘ(H2SO3ΓΔHSO3-ΚΆSO32-)¥φ‘Ύ”ΎΖ¥”ΠΚσΒΡ»ή“Κ÷–Θ§ΥϋΟ«ΒΡΈο÷ ΒΡΝΩΖ÷ ΐX(ΔΓ)”κ»ή“ΚpHΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ

ΔΌ»τ «0.1mol/LNaOH Ζ¥”ΠΚσΒΡ»ή“ΚΘ§≤βΒΟ»ή“ΚΒΡpH=8 ±Θ§»ή“Κ÷–ΗςάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρ «__________________ΓΘ
ΔΎœρpH=5ΒΡNaHSO3»ή“Κ÷–ΒΈΦ”“ΜΕ®≈®Ε»ΒΡCaCl2 »ή“ΚΘ§»ή“Κ÷–≥ωœ÷ΜκΉ«Θ§pHΫΒΈΣ2Θ§”ΟΜ·―ßΤΫΚβ“ΤΕ·‘≠άμΫβ Ά»ή“ΚpHΫΒΒΆΒΡ‘≠“ρ_________________________________ΓΘ
ΓΨ¥πΑΗΓΩ  CO(g)+2H2(g)=CH3OH(g) ΓςH=-99.7kJΓΛmol-1
CO(g)+2H2(g)=CH3OH(g) ΓςH=-99.7kJΓΛmol-1 ![]() AC 0.05molΓΛL-1ΓΛmin-1 ΘΨ ΘΦ c(Na+)ΘΨc(SO32-)ΘΨc(HSO3-)ΘΨc(OH-)ΘΨc(H+) “ρΈΣHSO3-‘Ύ»ή“Κ÷–Φ»ΡήΒγάκΘ§”÷ΡήΥ°ΫβΘ§Β±œρΤδ÷–Φ”»κ¬»Μ·ΗΤ ±Θ§ΖΔ…ζΖ¥”ΠCa2++SO32-=CaSO3ΓΐΘ§ ΙΤδΒγάκΤΫΚβHSO3-
AC 0.05molΓΛL-1ΓΛmin-1 ΘΨ ΘΦ c(Na+)ΘΨc(SO32-)ΘΨc(HSO3-)ΘΨc(OH-)ΘΨc(H+) “ρΈΣHSO3-‘Ύ»ή“Κ÷–Φ»ΡήΒγάκΘ§”÷ΡήΥ°ΫβΘ§Β±œρΤδ÷–Φ”»κ¬»Μ·ΗΤ ±Θ§ΖΔ…ζΖ¥”ΠCa2++SO32-=CaSO3ΓΐΘ§ ΙΤδΒγάκΤΫΚβHSO3-![]() H++SO32-÷–c(SO32-)Φθ–ΓΕχ’ΐœρ“ΤΕ·Θ§ΒΦ÷¬c(H+)‘ω¥σΘ§pHΦθ–Γ
H++SO32-÷–c(SO32-)Φθ–ΓΕχ’ΐœρ“ΤΕ·Θ§ΒΦ÷¬c(H+)‘ω¥σΘ§pHΦθ–Γ
ΓΨΫβΈωΓΩ(1)÷ςΉε‘ΣΥΊΒΡ‘≠Ή”ΚΥΆβΒγΉ”≈≈≤ΦΑ¥’’“ΜΑψΒΡΒγΉ”≈≈≤ΦΙφ¬…Φ¥Ω…Μ≠≥ωΤδ‘≠Ή”ΫαΙΙ Ψ“βΆΦΘΜ(2)”Π”ΟΗ«ΥΙΕ®¬…Ϋβ¥πΘΜ(3)Μ·―ßΤΫΚβΉ¥Χ§ΒΡ≈–Εœ“άΨί”–ΥΌ¬ ≈–ΨίΚΆΓΑΝΩΓ±≈–ΨίΝΫ÷÷Θ§’ΐ»ΖάμΫβΘ§»œ’φΖ÷ΈωΘ§“‘≤Μ±δ”ΠΆρ±δΘ§ «ΫβΧβΒΡΙΊΦϋΘΜάϊ”Ο±μΗώΚΆΆΦœσ–≈œΔΘ§ΗυΨίΖ¥”ΠΖΫ≥Χ ΫΫχ––ΓΑ»ΐΕΈ ΫΓ±Ζ÷ΈωΘ§”Π”ΟΒ»–ßΤΫΚβΓΔΆβΫγΧθΦΰΕ‘Ζ¥”ΠΥΌ¬ ΚΆΜ·―ßΤΫΚβΒΡ”ΑœλΒ»Ϋχ––ΉέΚœΖ÷ΈωΫβ¥πΔΎΔέΘ§ΧΊ±π «ΦΉΓΔ±ϊΝΫ»ίΤς÷–ΥΌ¬ ΒΡΩλ¬ΐΚΆ≤ζΈο≈®Ε»ΒΡ¥σ–ΓΒΡ”Αœλ“ρΥΊ «Ρ―ΒψΘΜ(4)ΗυΨίΆΦœσ–≈œΔΘ§”…»ή“ΚΒΡpHΦ¥Ω…ΒΟάκΉ”≈®Ε»ΒΡ¥σ–ΓΙΊœΒΘ§Η¥Ζ÷ΫβΖ¥”ΠΒΡΖΔ…ζ «ΒΦ÷¬»ή“ΚΥα–‘±δΜ·ΒΡ‘≠“ρΓΘ
(1)’ύ «ΒΎΥΡ÷ήΤΎΒΎΔτA‘ΣΥΊΘ§‘≠Ή”–ρ ΐΈΣ32Θ§Τδ‘≠Ή”ΫαΙΙ Ψ“βΆΦΈΣ ΓΘ
ΓΘ
(2)ΗυΨίΗ«ΥΙΕ®¬…Θ§Ζ¥”Π3-Ζ¥”Π2-Ζ¥”Π1Φ¥ΒΟ»»Μ·―ßΖΫ≥Χ ΫCO(g)+2H2(g)= CH3OH(g) ΓςH=ΓςH3-ΓςH2-ΓςH1= -99.7kJΓΛmol-1Θ§
(3)ΗυΨί2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) ΓςH4<0Θ§
CH3OCOOCH3(g)+H2O(g) ΓςH4<0Θ§
ΔΌΤδΤΫΚβ≥Θ ΐ±μ¥ο ΫΈΣK=![]() ΘΜ
ΘΜ
ΔΎΗυΨίΤΫΚβΉ¥Χ§ΒΡ≈–Εœ“άΨίΘ§AΓΔΒ±v’ΐ(CH3OH)= 2vΡφ(H2O) ±Θ§Ζ¥”Π“―¥οΤΫΚβΘΜBΓΔ”…”Ύ»ίΤςΧεΜΐ≤Μ±δΘ§ΤχΧε÷ ΝΩ ΊΚψΘ§Υυ“‘ΤχΧεΟήΕ» Φ÷’ΕΦ≤Μ±δΘ§Β±»ίΤςΡΎΤχΧεΟήΕ»≤Μ±δ ±≤ΜΡήΥΒΟςΖ¥”Π“―¥οΤΫΚβΘΜCΓΔ”…”ΎΖ¥”Π«ΑΚσΤχΧεΈο÷ ΒΡΝΩ≤ΜΒ»Θ§”…―Ι«Ω÷°±»Β»”ΎΈο÷ ΒΡΝΩ÷°±»Θ§Β±―Ι«Ω≤Μ±δ ±Θ§ΥΒΟςΖ¥”Π“―¥οΤΫΚβΘΜDΓΔCH3OH”κCO2ΒΡΈο÷ ΒΡΝΩ÷°±»»ΓΨω”ΎΤπ Φ ±Φ”»κΝΩ÷°±»Θ§»τΦ”»κΝΩ”κœΒ ΐ±»œύΒ»Θ§‘ρ»ΈΚΈ ±ΚρCH3OH”κCO2ΒΡΈο÷ ΒΡΝΩ÷°±»ΕΦ≤Μ±δΘ§Υυ“‘CH3OH”κCO2ΒΡΈο÷ ΒΡΝΩ÷°±»±Θ≥÷≤Μ±δ ±≤ΜΡήΥΒΟςΖ¥”Π“―¥οΤΫΚβΓΘ“ρ¥Υ±ΨΧβ¥πΑΗΈΣACΓΘ
Δέ”…ΆΦœσΩ…÷ΣΘ§ΦΉ»ίΤς‘Ύ5-15minΡΎΘ§DMCΒΡ≈®Ε»ΗΡ±δΝΥ0.5mol/LΘ§ΗυΨίΖ¥”ΠΖΫ≥Χ ΫΒΟΓςc(CO2)=0.5 mol/LΘ§‘ρ¥Υ ±ΦδΕΈΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣv(CO2) = ![]() =0.05molΓΛL-1ΓΛmin-1ΘΜ±»ΫœΦΉΓΔ““ΝΫ»ίΤςΤπ ΦΦ”»κΒΡΈο÷ ΒΡΝΩΘ§»τ‘ΎœύΆ§ΧθΦΰœ¬Θ§Εΰ’ΏΫ®ΝΔΒΡΤΫΚβ «Άξ»ΪΒ»–ßΤΫΚβΘ§ΆΦœσœ‘ ΨΦΉ»ίΤςΤΫΚβ ±cΦΉ ΤΫ(DMC)=1.5 mol/LΘ§‘ρnΦΉ ΤΫ(CO2) = 1mol-1.5 mol/LΓΝ0.5L=0.25molΘ§““»ίΤςΤΫΚβ ±n““ ΤΫ(CO2) =0.2mol< nΦΉ ΤΫ(CO2) =0.25molΘ§ΥΒΟς““»ίΤςœύΕ‘”ΎΦΉ»ίΤςΘ§ΤΫΚβœρ”““ΤΕ·Θ§“―÷ΣΗΟΖ¥”ΠΓςH4<0Θ§‘ρΫΒΒΆΈ¬Ε»Θ§Μ·―ßΤΫΚβœρ”““ΤΕ·Θ§Υυ“‘T1ΘΨT2ΘΜ”…”Ύ±ϊ»ίΤςΒΡΧεΜΐΚΆΈ¬Ε»ΕΦ≤Μ»ΖΕ®Θ§÷Μ «CO2ΒΡΈο÷ ΒΡΝΩ±»ΦΉ»ίΤς¥σΘ§”…ΆΦœσΩ…÷ΣΘ§±ϊΫ®ΝΔΤΫΚβΒΡΙΐ≥Χ÷–ΥΌ¬ ±»ΦΉΒΡΩλΘ§«“…ζ≥…ΈοDMCΒΡ≈®Ε»±»ΦΉΒΡ¥σΘ§”…”ΎΗΟΖ¥”Π «Ζ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»Θ§Ω…Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΒΪΤΫΚβΉσ“ΤΘ§ Ι…ζ≥…ΈοΒΡ≈®Ε»Φθ–ΓΘ§≤ΜΖϊΚœΆΦœσΥυ ΨΘΜ»τΧεΜΐΥθ–ΓΦ¥V<0.5LΘ§Φ¥Φ”―ΙΘ§Ω…Φ”ΩλΖ¥”ΠΥΌ¬ Θ§«“ΗΟΖ¥”Π «“ΜΗωΤχΧεΧεΜΐΥθ–ΓΒΡΖ¥”ΠΘ§Φ”―Ιœρ”““ΤΕ·Θ§Ζ¥”ΠΈοΉΣΜ·¬ ‘ω¥σΘ§…ζ≥…Έο≈®Ε»‘ω¥σΘ§ΖϊΚœΆΦœσΥυ ΨΘ§Υυ“‘ΦΉΓΔ±ϊΝΫ»ίΤςΒΡΖ¥”Π¥οΤΫΚβ ±CO2ΒΡΉΣΜ·¬ «ΦΉΘΦ±ϊΓΘ
=0.05molΓΛL-1ΓΛmin-1ΘΜ±»ΫœΦΉΓΔ““ΝΫ»ίΤςΤπ ΦΦ”»κΒΡΈο÷ ΒΡΝΩΘ§»τ‘ΎœύΆ§ΧθΦΰœ¬Θ§Εΰ’ΏΫ®ΝΔΒΡΤΫΚβ «Άξ»ΪΒ»–ßΤΫΚβΘ§ΆΦœσœ‘ ΨΦΉ»ίΤςΤΫΚβ ±cΦΉ ΤΫ(DMC)=1.5 mol/LΘ§‘ρnΦΉ ΤΫ(CO2) = 1mol-1.5 mol/LΓΝ0.5L=0.25molΘ§““»ίΤςΤΫΚβ ±n““ ΤΫ(CO2) =0.2mol< nΦΉ ΤΫ(CO2) =0.25molΘ§ΥΒΟς““»ίΤςœύΕ‘”ΎΦΉ»ίΤςΘ§ΤΫΚβœρ”““ΤΕ·Θ§“―÷ΣΗΟΖ¥”ΠΓςH4<0Θ§‘ρΫΒΒΆΈ¬Ε»Θ§Μ·―ßΤΫΚβœρ”““ΤΕ·Θ§Υυ“‘T1ΘΨT2ΘΜ”…”Ύ±ϊ»ίΤςΒΡΧεΜΐΚΆΈ¬Ε»ΕΦ≤Μ»ΖΕ®Θ§÷Μ «CO2ΒΡΈο÷ ΒΡΝΩ±»ΦΉ»ίΤς¥σΘ§”…ΆΦœσΩ…÷ΣΘ§±ϊΫ®ΝΔΤΫΚβΒΡΙΐ≥Χ÷–ΥΌ¬ ±»ΦΉΒΡΩλΘ§«“…ζ≥…ΈοDMCΒΡ≈®Ε»±»ΦΉΒΡ¥σΘ§”…”ΎΗΟΖ¥”Π «Ζ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»Θ§Ω…Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΒΪΤΫΚβΉσ“ΤΘ§ Ι…ζ≥…ΈοΒΡ≈®Ε»Φθ–ΓΘ§≤ΜΖϊΚœΆΦœσΥυ ΨΘΜ»τΧεΜΐΥθ–ΓΦ¥V<0.5LΘ§Φ¥Φ”―ΙΘ§Ω…Φ”ΩλΖ¥”ΠΥΌ¬ Θ§«“ΗΟΖ¥”Π «“ΜΗωΤχΧεΧεΜΐΥθ–ΓΒΡΖ¥”ΠΘ§Φ”―Ιœρ”““ΤΕ·Θ§Ζ¥”ΠΈοΉΣΜ·¬ ‘ω¥σΘ§…ζ≥…Έο≈®Ε»‘ω¥σΘ§ΖϊΚœΆΦœσΥυ ΨΘ§Υυ“‘ΦΉΓΔ±ϊΝΫ»ίΤςΒΡΖ¥”Π¥οΤΫΚβ ±CO2ΒΡΉΣΜ·¬ «ΦΉΘΦ±ϊΓΘ
(4)ΔΌ”…ΆΦœσΩ…÷ΣΘ§Β±»ή“ΚΒΡpH=8 ±Θ§c(SO32-)ΘΨc(HSO3-)Θ§«“c(OH-)ΘΨc(H+)Θ§Υυ“‘»ή“Κ÷–ΗςάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρ «c(Na+)ΘΨc(SO32-)ΘΨc(HSO3-)ΘΨc(OH-)ΘΨc(H+)ΘΜ
ΔΎHSO3-‘Ύ»ή“Κ÷–Φ»”–ΒγάκΤΫΚβΘ§“≤”–Υ°ΫβΤΫΚβΘ§Β±œρΤδ÷–ΒΈΦ”CaCl2»ή“Κ ±Θ§ΖΔ…ζΖ¥”ΠCa2++ SO32-=CaSO3ΓΐΘ§ ΙΤδΒγάκΤΫΚβHSO3-![]() H++SO32-“ρc(SO32-)Φθ–ΓΕχ’ΐœρ“ΤΕ·Θ§ΒΦ÷¬c(H+)‘ω¥σΘ§pHΦθ–ΓΓΘ
H++SO32-“ρc(SO32-)Φθ–ΓΕχ’ΐœρ“ΤΕ·Θ§ΒΦ÷¬c(H+)‘ω¥σΘ§pHΦθ–ΓΓΘ

ΓΨΧβΡΩΓΩœ¬Ν– Β―ιœ÷œσΟη ω¥μΈσΒΡ «
±ύΚ≈ | Β―ι | œ÷œσ |
A | Φ”»»Ζ≈‘Ύέαέω÷–ΒΡ–ΓΩιΡΤ | ΡΤœ»»έΜ·≥…ΙβΝΝΒΡ–Γ«ρΘ§»Φ…’ ±Θ§Μπ―φΈΣΜΤ…ΪΘ§»Φ…’ΚσΘ§…ζ≥…Β≠ΜΤ…ΪΙΧΧε |
B | ‘ΎΨΤΨΪΒΤ…œΦ”»»”Ο…Α÷Ϋ¥ρΡΞΙΐΒΡ¬Ν≤≠ | ¬Ν≤≠±δ»μΘ§ ß»ΞΙβ‘σΘ§»έΜ·ΒΡ¬Ν≤Δ≤ΜΒΈ¬δ |
C | ‘ΎFeCl2»ή“Κ÷–ΒΈ»κNaOH»ή“Κ | …ζ≥…ΑΉ…Ϊ≥ΝΒμΘ§≥ΝΒμΚήΩλ±δΈΣΜ“¬Χ…ΪΘ§ΉνΚσ±δΈΣΚλΚ÷…Ϊ |
D | ΫΪΥ°’τΤχΆ®ΙΐΉΤ»»ΒΡΧζΖέ | ΚΎ…ΪΖέΡ©±δΈΣΚλΚ÷…Ϊ |
A. A B. B C. C D. D
ΓΨΧβΡΩΓΩΡ≥–ΘΜ·―ß–Υ»Λ–ΓΉιΒΡΆ§―ßΕ‘Κ§”–…ΌΝΩNa2SO4ΒΡNaOH―υΤΖ÷–NaOHΒΡΚ§ΝΩΫχ––≤βΕ®ΓΘΜΊ¥πœ¬Ν–Έ Χβ:
Θ®1Θ©ΦΉΆ§―ß‘Υ”Ο≥ΝΒμΖ®≤βΕ®―υΤΖ÷–NaOHΒΡΚ§ΝΩΓΘΗΟΆ§―ß―Γ”ΟΒΡ“©ΤΖ”–―υΤΖΓΔ’τΝσΥ°ΓΔMgCl2»ή“ΚΘ§–η“Σ≤βΕ®ΒΡ Β―ι ΐΨί”–__________ΓΘ
Θ®2Θ©““Ά§―ß‘Υ”Ο÷–ΚΆΒΈΕ®Ζ®≤βΕ®―υΤΖ÷–NaOHΒΡΚ§ΝΩΓΘ
ΔΌ”ΟΖ÷ΈωΧλΤΫΉΦ»Ζ≥Τ»ΓΗΟ―υΤΖ5.0000 gΘ§»Ϊ≤Ω»ή”ΎΥ°≈δ÷Τ≥…1000.0 mL»ή“ΚΓΘ”ΟΦν ΫΒΈΕ®ΙήΝΩ»Γ20.00 mLΥυ≈δ»ή“ΚΖ≈‘ΎΉΕ–ΈΤΩ÷–Θ§ΒΈΦ”ΦΗΒΈ÷Η ΨΦΝΘ§¥ΐ≤βΓΘΒΈΕ®Ιή‘Ύ Ι”Ο«Α≥ΐœ¥Β”ΆβΘ§ΜΙ”Π____________________________________ΓΘ
ΔΎ”Ο≈®Ε»ΈΣ0.100 0 molΓΛLΘ≠1ΒΡ―ΈΥα±ξΉΦ»ή“ΚΫχ––ΒΈΕ®ΓΘΩΣ ΦΒΈΕ®«ΑΒΡ“Μ≤Ϋ≤ΌΉς «________ΓΘ
ΔέΒΈΕ®Ιΐ≥Χ÷–”ΟpHΦΤ≤βΕ®ΉΕ–ΈΤΩ÷–»ή“ΚΒΡpHΘ§ΝΌΫϋΒΈΕ®÷’Βψ ±≤βΕ®pH”ΠΟΩΒΈ“ΜΒΈ≤β“Μ¥ΈΓΘ
ΔήΒΈΕ®Ιΐ≥Χ÷–Θ§ΉΕ–ΈΤΩ÷–»ή“ΚΒΡpH±δΜ·»γœ¬ΘΚ
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
«κ‘ΎΉχ±ξΆΦ÷–Μφ÷Τ≥ω…œ ω÷–ΚΆΒΈΕ®ΒΡ«ζœΏΓΘ______________

Δί»γ±μΥυ Ψ «ΦΗ÷÷ΥαΦν÷Η ΨΦΝΒΡ±δ…ΪΖΕΈßΘ§ΗυΨίΡψΥυΉςΒΡ÷–ΚΆΒΈΕ®«ζœΏΖ÷ΈωΘ§…œ ω÷–ΚΆΒΈΕ®÷–”Π―Γ”ΟΒΡ÷Η ΨΦΝ «________ΓΘ
÷Η ΨΦΝ | ±δ…ΪΖΕΈß(pH) | ―’…Ϊ | |
Υα | Φν | ||
ΦΉΜυ≥» | 3.1ΓΪ4.4 | Κλ | ΜΤ |
·»ο | 5.0ΓΪ8.0 | Κλ | άΕ |
Ζ”ΧΣ | 8.2ΓΪ10.0 | Έό | Κλ |
Δό―υΤΖ÷–Θ§NaOHΒΡ÷ ΝΩΑΌΖ÷Κ§ΝΩΈΣ____________ΓΘ