题目内容
20. 实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理:2HCHO+KOH-→CH3OH+HCOOK
实验室中用苯甲醛制备苯甲醇和苯甲酸,已知反应原理:2HCHO+KOH-→CH3OH+HCOOK苯甲醛易被空气氧化;苯甲醇的沸点为205.3℃;苯甲酸的熔点121.7℃,沸点249℃,溶解度0.34g(常温).乙醚的沸点34.8℃,难溶于水.
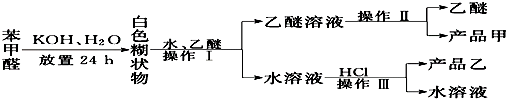
制备苯甲醇和苯甲酸的主要过程如下:
(1)混合苯甲醛、氢氧化钾和水应选用的仪器是A (填序号).
A.带瓶塞的锥形瓶 B.烧杯 C.容量瓶
(2)操作Ⅰ使用的主要玻璃仪器有:分液漏斗、烧杯;操作Ⅱ的名称是蒸馏;产品乙是苯甲酸(填名称).
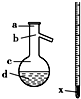
(3)在上述使用下图所示仪器的操作中,温度计水银球x的放置位置为b (填图标a、b、c、d).控制蒸气的温度为34.8℃.
(4)产品甲和产品乙在一定条件下能反应生成一种有特殊香味的物质,写出该反应的化学方程式
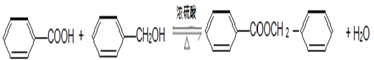 ,实验室在收集此特殊香味的物质时常用饱和Na2CO3溶液 (填试剂名称)除去其中的杂质,且便于其分层析出.
,实验室在收集此特殊香味的物质时常用饱和Na2CO3溶液 (填试剂名称)除去其中的杂质,且便于其分层析出.
分析 由流程结合题中信息可知,苯甲醛与KOH反应生成白色糊状物为苯甲醇、苯甲酸钾的混合物,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答.
(1)苯甲醛易被空气氧化,需在带胶塞的锥形瓶中进行混合苯甲醛、氢氧化钾和水;
(2)萃取、分液操作实验时用到的玻璃仪器为烧杯和分液漏斗,操作II为蒸馏,得到产品甲为苯甲醇;操作Ⅲ为过滤,产品乙为苯甲酸;
(3)蒸馏时,温度计的水银球应在支管口;通过蒸馏分离出的是乙醚,根据乙醚的沸点可知控制蒸气的温度;
(4)甲为苯甲醇,乙为苯甲酸,两者发生酯化反应,酸脱羟基、醇脱氢,据此书写方程式,实验室在收集此特殊香味的物质时常用饱和Na2CO3溶液除去其中的杂质羧酸和醇.
解答 解:由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸.
(1)苯甲醛易被空气氧化,所以混合苯甲醛、氢氧化钾和水时,应在带胶塞的锥形瓶中进行,避免与空气过多接触,即A正确,
故答案为:A;
(2)据上述分析,操作Ⅰ为萃取、分液,使用的主要玻璃仪器有:分液漏斗、烧杯,乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇,水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,
故答案为:分液漏斗、烧杯;蒸馏;苯甲酸;
(3)蒸馏时,温度计的水银球应在支管口,则温度计水银球x的放置位置为b;通过蒸馏分离出的是乙醚,根据乙醚的沸点可知控制蒸气的温度为34.8℃,
故答案为:b;34.8℃;
(4)甲为苯甲醇,乙为苯甲酸,苯甲醇与苯甲酸发生酯化反应生成酯和水,该反应为: ,羧酸、
,羧酸、
醇易挥发,制得的酯中含有醇和酸,选用饱和的碳酸钠,可降低酯的溶解度,与羧酸反应,溶解醇,便于液体分层酯在上层,
故答案为: ;饱和Na2CO3溶液.
;饱和Na2CO3溶液.
点评 本题考查制备方案的设计,为高频考点,题目难度中等,把握有机物的性质及分离流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 金属Al溶于稀硝酸中:2Al+6H+═2Al3++3H2↑ | |
| B. | CuH在足量C12中燃烧:2CuH+2Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+H2 | |
| C. | 向复盐NH4Al(S04)2溶液中加入Ba(0H)2至沉淀质量最大:NH4++Al3++4OH-+2SO42-═NH3•H2O+Al(OH)3↓+2BaSO4↓ | |
| D. | 向饱和NaHSO3溶液中加入FeC13溶液:S032-+2Fe3++H20═S042-+2Fe2++2H+ |
 某实验小组利用如下装置合成正丁醛.发生的反应如下:
某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分.
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水会放出大量热,容易溅出伤人.
(2)加入沸石的作用是防止暴沸.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)温度计C1的作用测量烧瓶中反应物的温度,C2的作用测量馏分的沸点.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置及有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是B(填正确选项前的字母)
A.引发反应 B.减少副产物 C.防止乙醇挥发
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)
A.饱和碳酸氢钠溶液 B.浓硫酸 C.氢氧化钠溶液
(3)判断装置D中该制备反应已经结束的最简单方法是观察溴水颜色是否褪尽
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”)
(5)若产物中有少量副产物乙醚,除去乙醚的方法是蒸馏(填实验操作方法)
| A. | 6个碳原子形成的烃分子中,最多有5个C-C单键 | |
| B. | C2H4的结构简式可表示为CH2CH2 | |
| C. | C3H6分子中一定含有C═C双键 | |
| D. | C6H6分子中,所有原子均可能在同一平面内 |

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 石墨和金刚石是同分异构体 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 |
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: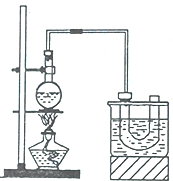 在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):
在实验条件许可的情况下,实验室也可以进行某些有机物的制备.实验室制备溴乙烷(C2H5Br)的装置和步骤如下(已知溴乙烷的沸点38.4℃,密度比水大,难溶于水):