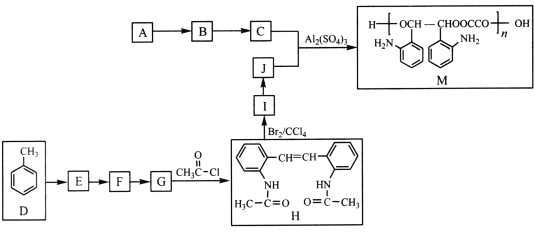
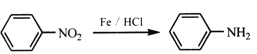
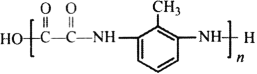
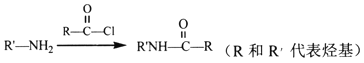题目内容
【题目】在25℃时,将1.0 L w mol·L-1 CH3COOH 溶液与0.1 mol NaOH固体混合,充分反应。向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH随加入CH3COOH或CH3COONa固体的物质的量的变化关系如图所示。下列叙述正确的是
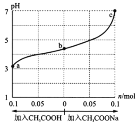
A.b点混合液中c(H+)≥ c(OH-) + c(CH3COO-)
B.加入CH3COOH过程中,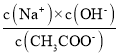 增大
增大
C.25℃时,CH3COOH的电离平衡常数 Ka= ![]() mol·L-1
mol·L-1
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
【答案】C
【解析】
CH3COOH溶液与0.1molNaOH 固体混合,CH3COOH+NaOH=CH3COONa+H2O,a点显酸性,故形成CH3COOH和CH3COONa的混合溶液。若向该混合溶液中通入CH3COOH,CH3COONa减少,CH3COOH增多;若向该混合溶液中加入CH3COONa固体,CH3COONa增多,CH3COOH减少。
A.根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由题可知,在b点时,c(H+)<c(OH-) + c(CH3COO-),A错误;
B.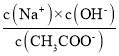 =
=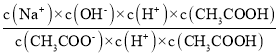 =
=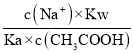 =
= ,加入CH3COOH过程中,n(Na+)不变,n(CH3COOH)增大,所以
,加入CH3COOH过程中,n(Na+)不变,n(CH3COOH)增大,所以 减小,故
减小,故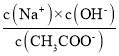 减小,B错误;
减小,B错误;
C.根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c点时,溶液pH=7,有c(H+)=c(OH-),则c(Na+)= c(CH3COO-),![]() ,溶液中
,溶液中![]() ,根据物料守恒:
,根据物料守恒:![]() ,则醋酸的电离平衡常数为:
,则醋酸的电离平衡常数为: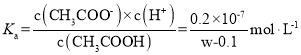 ,C正确;
,C正确;
D.溶液中酸或碱电离的氢离子或氢氧根浓度越大,水的电离程度越小,由题可知, a、b、c对应的混合液中pH≤7,醋酸对水的电离的抑制程度大于醋酸根离子对水的电离的促进程度,水的电离均受到抑制,由于氢离子浓度a>b>c,则水的电离程度由大到小的顺序是c>b> a,D错误。
答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。
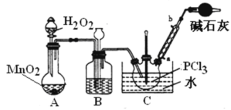
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
资料:① Ag+ + SCN- =AgSCN↓,Ksp(AgCl) >Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)PCl3分子中各原子均满足8电子稳定结构,则PCl3的电子式为____。
(2)B中所盛的试剂是____,干燥管的作用是________。
(3)POCl3遇水反应的化学方程式为_____________。
(4)反应温度要控制在60~65℃,原因是:__________。
II.工业上可用氯化水解法生产三氯氧磷,工艺流程如下:
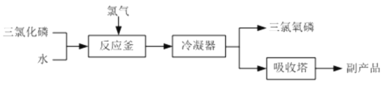
(5)氯化水解法生产三氯氧磷的化学方程式为____。
(6)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
a、准确称取30.7 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
b、取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol·L-1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以X为指示剂,用0.2 mol·L-1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤c中加入硝基苯的作用是____。
②步骤d中X为______。
A FeCl2 B NH4Fe(SO4)2 C 淀粉 D 甲基橙
③三氯氧磷产品中Cl元素的质量百分含量为____。