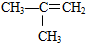题目内容
18.在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
(1)画出D的原子结构示意图
 ;
;(2)写出C的最高价氧化物的电子式
 ,该化合物所含化学键为共价键;
,该化合物所含化学键为共价键;(3)E和F分别形成的气态氢化物中最稳定的是HCl(填写氢化物的化学式);
(4)A最高价氧化物的水化物的化学式NaOH.
分析 根据元素在周期表中的分布可知A是Na,B是Al,C是C,D是N,E是S,F是Cl.
(1)D为N元素,原子核外有2个电子层,最外层电子数为5;
(2)C为碳元素,最高价氧化物为二氧化碳,为共价化合物;
(3)同主族元素的原子从上到下,氢化物的稳定性逐渐减弱;同周期元素的原子从左到右,氢化物的稳定性逐渐增强;
(4)元素A为钠,最高价氧化物的水化物是氢氧化钠.
解答 解:根据元素在周期表中的分布知识,可以知道A是Na,B是Al,C是C,D是N,E是S,F是Cl.
(1)D为N元素,原子核外有2个电子层,最外层电子数为5,N的原子结构示意图 ,故答案为:
,故答案为: ;
;
(2)C的最高价氧化物为二氧化碳,电子式为 ,含有共价键,故答案为:
,含有共价键,故答案为: ;共价键;
;共价键;
(3)同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以F的氢化物稳定,故答案为:HCl;
(4)元素A为钠,最高价氧化物的水化物是氢氧化钠,故答案为:NaOH.
点评 本题考查元素周期表、化学用语、元素化合物性质等,为高考常见题型,比较基础,旨在考查学生对基础知识的理解掌握,注意整体把握元素周期表的结构.

练习册系列答案
相关题目
9.L电子层最多可容纳的电子数为( )
| A. | 3个 | B. | 8个 | C. | 9个 | D. | 18个 |
6.指出下列化合物中化学键的类型、物质分类(离子化合物、共价化合物)以及溶于水时破坏的化学键的类型.
| 化合物 | 化学键的类型 | 物质分类 | 溶于水时破坏的化学键的类型 |
| Na2S | |||
| HCl | |||
| (NH4)2SO4 |
10.下列说法正确的是( )
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 在一定条件下2mol SO2与 1mol O2混合一定能生成2mol SO3 |
7.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得. 下列有关说法正确的是( )
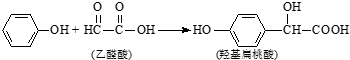
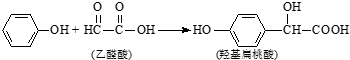
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1mol Br2反应 | |
| C. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 | |
| D. | 羟基扁桃酸可以发生取代、氧化、加成等反应 |
 酚
酚 酯
酯 醛
醛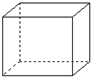 有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为
有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为  .“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图:
.“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图: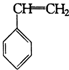 B.
B. 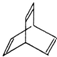 C.
C.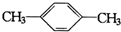 D.
D.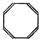
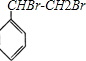 .
.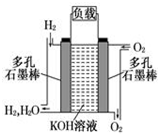 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回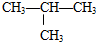 ⑤
⑤