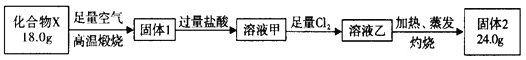
题目内容
【题目】材料与生产、生活和科技密切相关。回答下列问题:
(1)下列物质中属于复合材料的是___________(填标号)。
A.钢化玻璃 B.玻璃钢 C.钢筋混凝土 D.水泥
(2)钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,请以氧化物组成的形式表示钾长石的化学式____________。
(3)新型无机非金属材料碳化硅陶瓷(SiC)是一种耐高温陶瓷,反应原理为SiO2+3C![]() SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________。
SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________。
(4)金属材料的应用更是广泛。①工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是________________。
②铝热反应可用于冶炼难熔的金属,请写出Al与Cr2O3反应的化学方程式_________。
【答案】BC K2O·Al2O3·6SiO2 1:2 Fe3+、Cu2+ 2Al+Cr2O3![]() 2Cr+Al2O3
2Cr+Al2O3
【解析】
(1)复合材料是将两种或两种以上性质不同的材料经特殊加工而成的材料;其中,一种材料作为基体,另一种材料作增强剂;
(2)用氧化物组成的形式表示硅酸盐时,先写金属氧化物(按金属活泼性依次书写),再写非金属性氧化物,要注意各种元素的原子个数比不变;
(3)还原剂中所含元素化合价升高,氧化剂中所含元素化合价降低,据此分析;
(4)①根据氧化性Fe3+>Cu2+>Fe2+分析解答;
②Al与Cr2O3在高温下反应产生Al2O3、Cr。
(1)复合材料是将两种或两种以上性质不同的材料经特殊加工而成的材料;其中,一种材料作为基体,另一种材料作增强剂,属于复合材料的是玻璃钢和钢筋混凝土,故合理选项是BC;
(2)钾长石(K2Al2Si6O16)是硅酸盐,用氧化物的形式表示为K2O·Al2O3·6SiO2;
(3)在反应SiO2+3C![]() SiC+2CO↑中,C元素的化合价一部分升高变为CO,作还原剂,一部分化合价降低,变为SiC,作氧化剂,根据化合价升降总数相等,可知在该反应中氧化剂与还原剂的物质的量之比为1:2;
SiC+2CO↑中,C元素的化合价一部分升高变为CO,作还原剂,一部分化合价降低,变为SiC,作氧化剂,根据化合价升降总数相等,可知在该反应中氧化剂与还原剂的物质的量之比为1:2;
(4)①由于微粒的氧化性Fe3+>Cu2+>Fe2+,向含有上述离子的溶液中加入足量的Fe粉,会发生反应:2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+,所以当向腐蚀液中加入足量的Fe粉,一定不存在的离子是Fe3+、Cu2+;
②Al与Cr2O3在高温下反应产生Al2O3、Cr,根据原子守恒、电子守恒,可得反应方程式为:2Al+Cr2O3![]() 2Cr+Al2O3。
2Cr+Al2O3。

【题目】室温下,将一元酸HA溶液和KOH溶液等体积混合,实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
[HA] | [KOH] | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:[K+]>[A-]>[OH-]>[H+]
B. 实验①反应后的溶液中:[OH-]=[K+]-[A-]=![]() mol·L-1
mol·L-1
C. 实验②反应后的溶液中:[A-]+[HA]>0.1 mol·L-1
D. 实验②反应后的溶液中:[K+]=[A-]>[OH-]=[H+]
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
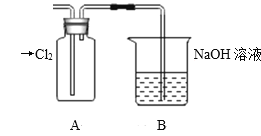
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
【题目】试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
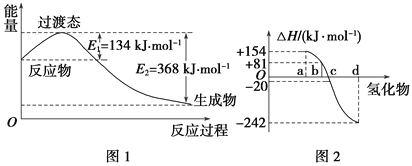
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。