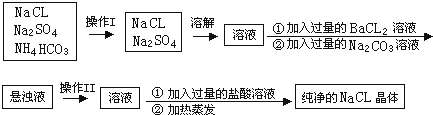
题目内容
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________________。
(2)表中Y,硫和Z三种元素的简单离子半径由大到小的顺序是(填离子符号)____________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2mol Mg(OH)2和1mol气态烃。该烃分子中碳氢质量比为9∶1,烃的电子式为__________________,Q与水反应的化学方程式为__________________________。
【答案】 第三周期第ⅦA族 S2->Cl->O2- ac 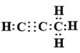 Mg2C3+4H2O=2Mg(OH)2+C3H4↑
Mg2C3+4H2O=2Mg(OH)2+C3H4↑
【解析】根据元素在周期表中的位置可判断X是S,Y是O,Z是Cl,则
(1)Cl元素在周期表中的位置为第三周期第ⅦA族。(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则表中Y,硫和Z三种元素的简单离子半径由大到小的顺序是S2->Cl->O2-。(3)a.Y单质与H2S溶液反应,溶液变浑浊,说明置换出单质S,因此可以说明氧元素非金属性强于硫,a正确;b.非金属性强弱与得电子多少没有关系,只与难易程度有关系,b错误;c.Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明氢化物稳定性强,因此可以说明氧元素非金属性强于硫,c正确;答案选ac;(4)该烃分子中碳氢质量比为9∶1,则原子个数之比是9/12:1=3:4,由于Q是Mg2C3,所以根据原子守恒可知烃的分子式为C3H4,电子式为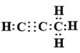 ,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑。
,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑。