题目内容
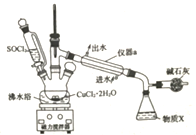
【题目】为除去粗盐中的Ca2+、Mg2+、SO42﹣以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): 称取粗盐 ![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 精盐
精盐
(1)第①步中,操作A是 , 第⑤步中,操作B是 .
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2) .
(3)若先加入盐酸再过滤,将对实验结果产生影响,其原因是 .
(4)判断Na2CO3已过量的方法是 .
【答案】
(1)溶解;过滤
(2)CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl
(3)操作③④中生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制得精盐的纯度
(4)取少量上层清液滴加盐酸有气泡冒出
【解析】解:(1)在粗盐提纯之前要先将粗盐溶解于水中,第①步中,操作A是溶解,第⑤步中的操作是实现固体和液体的分离方法,即过滤,所以答案是:溶解;过滤;(2)在粗盐提纯时,可以加入碳酸钠除去钙离子和多余的钡离子,发生的反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl, 所以答案是:CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;(3)在粗盐提纯时,若先用盐酸调pH再过滤,那样生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而使制得精盐中含有一些杂质,
所以答案是:操作③④中生成的Mg(OH)2、CaCO3、BaCO3会与盐酸反应,从而影响制得精盐的纯度;(4)判断Na2CO3已过量的方法是取少量上层清液滴加盐酸有气泡冒出,所以答案是:取少量上层清液滴加盐酸有气泡冒出.

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________________。
(2)表中Y,硫和Z三种元素的简单离子半径由大到小的顺序是(填离子符号)____________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2mol Mg(OH)2和1mol气态烃。该烃分子中碳氢质量比为9∶1,烃的电子式为__________________,Q与水反应的化学方程式为__________________________。