题目内容
15.下列说法正确的是( )| A. | 实验中需用0.20 mol•L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g | |
| B. | 升高NH4Cl溶液温度,其水的离子积常数和pH均增大 | |
| C. | 水比硫化氢稳定的原因是水分子间存在氢键 | |
| D. | 在pH等于2的醋酸溶液中加入少量0.01 mol•L-1的稀盐酸,溶液的pH会变小 |
分析 A、由于没有950mL的容量瓶,选择大于950mL相近规格的容量瓶;根据m=cnM计算所需NaOH的质量;
B、升高温度促进氯化铵的水解,酸性增强,pH减小;
C、水比硫化氢稳定的原因是氧的非金属性强于硫;
D、在pH等于2的醋酸溶液中加入少量0.01 mol•L-1的稀盐酸,氢离子浓度不变,醋酸的电离平衡不移动.
解答 解:A、由于没有950mL的容量瓶,选择大于950mL相近规格的容量瓶;根据m=cVM=0.20 mol•L-1×1L×40g/mol=8.0g,故A正确;
B、升高温度促进氯化铵的水解,酸性增强,pH减小,故B错误;
C、水比硫化氢稳定的原因是氧的非金属性强于硫,无氢键无关,故C错误;
D、加入溶液中氢离子浓度不变,溶液pH不变,故D错误;
故选A.
点评 本题考查了影响若使电离平衡移动的因素、影响水解平衡移动的因素、溶液中的电荷守恒和物料守恒、混合溶液平衡的计算,题目难度较大.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1 | |
| B. | 按系统命名法,化合物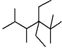 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| C. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| D. | 肌醇 与葡萄糖 与葡萄糖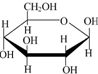 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
6.下列有关硅和硅的化合物的叙述中正确的是( )
| A. | 二氧化硅是良好的半导体材料,可用于制造集成电路、晶体管器件和硅芯片等 | |
| B. | 硅的化学性质很稳定,常温下与酸、碱、盐等难以反应 | |
| C. | 硅酸俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 向含有少量酚酞的硅酸钠溶液中逐滴加入稀盐酸,边加边振荡,可以看到溶液红色逐渐消失 |
10.为达到预期的实验目的,下列操作正确的是( )
| A. | 欲制备Fe(OH)3 胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| B. | 用碘的水溶液鉴别乙醇、四氯化碳 | |
| C. | 欲配制质量分数为10%的CuSO4溶液,将l0 g CuSO4•5H2O 溶解在90 g 水中 | |
| D. | 为减小误差,容量瓶必须干燥后才可使用 |
20. 如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
 如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加入的是CCl4,②加汽油,③加酒精 | B. | ①加入的是汽油,②加CCl4,③加酒精 | ||
| C. | ①加入的是汽油,②加酒精,③加CCl4 | D. | ①加入的是酒精,②加CCl4,③加汽油 |
7.下列两种气体的分子数一定相等的是( )
| A. | 质量相等、密度不等的N2和C2H4 | B. | 相同压强、相同体积的CO和O2 | ||
| C. | 相同温度、相同体积的O2和N2 | D. | 质量相等的N2和CO2 |
4.下列描述或表达式正确的是( )
| A. | 反应MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化转移2mol电子 | |
| B. | NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4- | |
| C. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| D. | 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.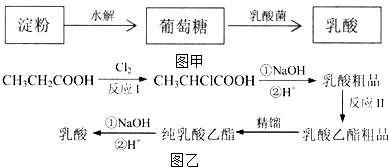
 乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n
乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.