题目内容
4.下列描述或表达式正确的是( )| A. | 反应MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化转移2mol电子 | |
| B. | NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4- | |
| C. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| D. | 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
分析 A.反应中Mn元素的化合价降低;
B.熔融时破坏离子键;
C.难溶性的盐在水中能完全电离属于强电解质;
D.电离是在水的作用下发生的.
解答 解:A.反应中Mn元素的化合价降低被还原,则1molMnO2被还原转移2mol电子,故A错误;
B.熔融时破坏离子键,则NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4-,故B正确;
C.难溶性的盐在水中能完全电离属于强电解质,则不溶于水的盐(CaCO3、BaSO4等)都是强电解质,故C错误;
D.电离是在水的作用下发生的,不需要通电,电化腐蚀是金属发生原电池反应,不需要通电,故D错误.
故选B.
点评 本题考查了氧化还原反应、离子键、电解质等,题目难度不大,侧重于基础知识的综合应用的考查.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
15.下列说法正确的是( )
| A. | 实验中需用0.20 mol•L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g | |
| B. | 升高NH4Cl溶液温度,其水的离子积常数和pH均增大 | |
| C. | 水比硫化氢稳定的原因是水分子间存在氢键 | |
| D. | 在pH等于2的醋酸溶液中加入少量0.01 mol•L-1的稀盐酸,溶液的pH会变小 |
12.在某澄清、透明的浅黄色溶液中,可能含有:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-八种离子中的几种,在检验方案设计时初步分析其溶液中最多可含的离子(不包括OH-)有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
19.用合适的容量瓶配制480mL1.0mol•L-1NaNO2溶液时,需称取溶质质量为( )
| A. | 13.8g | B. | 69g | C. | 34.5g | D. | 33.1g |
9.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g);
(1)判断反应达到平衡状态的依据是cd(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等 b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2}).c(CO)}$,△H<0(填“>”、“<”或“=”).
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/c(CH3OH)减小
④某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L•min).
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”);
(4)已知在常温常压下: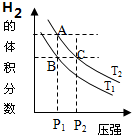
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1 .
(1)判断反应达到平衡状态的依据是cd(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等 b. 混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/c(CH3OH)减小
④某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L•min).
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”);
(4)已知在常温常压下:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1 .
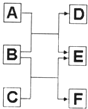 A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有如图的转化关系.
A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有如图的转化关系.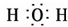
 .
.

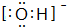 .
.