题目内容
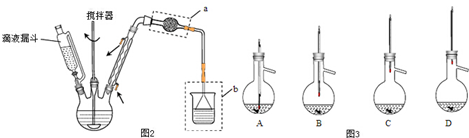
3.(1)亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,除了选择Na2SO3溶液还应选用的试剂有溴水(填名称),看到的现象是 _溴水褪色,反应的离子方程式为SO32-+Br2+H2O=SO42-+2Br-+2H+.(2)实验室制取氯气的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCI2+Cl2↑+2H2O.
(3)由SiO2 制取粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
(4)将ag由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为= ag (>;<;=).
分析 (1)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,可与亚硫酸钠发生氧化还原反应;
(2)实验室制取氯气的反应物是二氧化锰和浓盐酸,产物是氯化锰和氯气、水,条件是加热;
(3)碳与二氧化硅反应生成硅单质和一氧化碳;
(4)CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;H2在氧气中完全燃烧生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,以此解答该题.
解答 解:(1)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,则选择的试剂为Na2SO3溶液、溴水,二者发生氧化还原反应,可观察到溴水褪色,反应的离子方程式为Br2+SO32-+H2O=2Br-+SO42-+2H+,
故答案为:溴水;溴水褪色;Br2+SO32-+H2O=2Br-+SO42-+2H+;
(2)实验室中用二氧化锰和浓盐酸加热来制取氯气,原理是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCI2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCI2+Cl2↑+2H2O;
(3)工业上制取粗硅的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$2CO+Si,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
(4)CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;H2在氧气中完全燃烧生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,故由agCO和H2组成的混合物在足量的O2中充分燃烧,立即通入足量的Na2O2固体,固体质量增加应为CO和H2的质量,即固体增重为ag,
故答案为:=.
点评 本题考查氧化还原反应知识、化学方程式书写、混合物计算,侧重于学生的分析能力和元素化合物知识的综合运用,注意把握常见含硫化合物的性质、(4)注意(CO)x.yH2形式,完全燃烧后通入足量过氧化钠,过氧化钠增重为该物质的质量,题目难度中等.

 期末集结号系列答案
期末集结号系列答案| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 1:3 |
| A. | 50mL | B. | 50.5mL | C. | 55mL | D. | 59.5mL |
| A. | 2丁烯 | B. | 甲苯 | C. | 1丁烯 | D. | 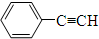 |
| A. | 实验中需用0.20 mol•L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g | |
| B. | 升高NH4Cl溶液温度,其水的离子积常数和pH均增大 | |
| C. | 水比硫化氢稳定的原因是水分子间存在氢键 | |
| D. | 在pH等于2的醋酸溶液中加入少量0.01 mol•L-1的稀盐酸,溶液的pH会变小 |
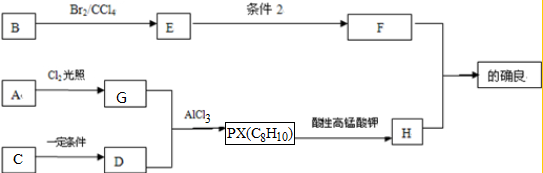
 A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有如图的转化关系.
A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有如图的转化关系.
 .
.
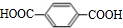 +nHOCH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+nHOCH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$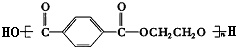 +(2n-1)H2O 其反应类型是:缩聚反应.
+(2n-1)H2O 其反应类型是:缩聚反应.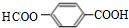 、
、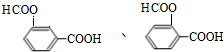 (其中两种).
(其中两种).