题目内容
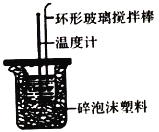
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量简量取30mL0.50 molL-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.50molL-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)如果用30mL0.50mol/L硫酸与70mL0.50mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”),简述理由_____________________。
(2)某实验小组配制0.50mol/LNaOH溶液,若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_____________________g。
(3)若用KOH代替NaOH,对测定结果___________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_____________(填“有”或“无”)影响。
(4)①近似认为0.50 molL-1硫酸和0.50 molL-1NaOH溶液密度都是1g·cm3,中和后溶液温度上升了4℃,生成溶液的比热容c=4.18J·(g·℃)-1,则中和热△H=______(小数点后保留一位有效数字)。
②上述实验结果与-57.3kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
A.实验装置保温隔热效果差
B.量取NaOH溶液体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
【答案】 不相等 相等 中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关 5.0 无 有 -53.5kJ·mol-1 ACD
【解析】本题主要考查测定中和热实验。
(1)如果用30mL0.50mol/L 硫酸与70mL0.50mol/LNaOH 溶液进行反应,与上述实验相比,参加反应的酸碱多少不同,所放出的热量不相等,所求中和热相等,简述理由:中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关。
(2)某实验小组配制0.50mol/LNaOH溶液,若实验中大约要使用245mLNaOH溶液,需要选择250mL容量瓶配制溶液,至少需要称量NaOH固体0.5mol/L×0.25L×40g/mol=5.0g。
(3)若用KOH代替NaOH,对测定结果无影响;若用醋酸代替HCl做实验,醋酸电离吸热,对测定结果有影响。
(4)①中和热△H=4℃×4.18J·(g·℃)-1×80g/0.025mol=53.5kJ·mol-1。
②A.热量散失,温度上升值减小,测定结果偏小;B.NaOH溶液体积增大,温度上升值增大,测定结果偏大;C. 热量散失,温度上升值减小,测定结果偏小;D. 热量散失,温度上升值减小,测定结果偏小。故选ACD。

【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。