题目内容
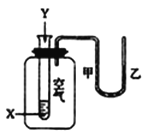
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
【答案】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑70%的硫酸中c(H+)比98%的硫酸大2Fe3++SO2+2H2O=2Fe2++SO42-+4H+I、Ⅲ
MnCl2+2H2O+Cl2↑70%的硫酸中c(H+)比98%的硫酸大2Fe3++SO2+2H2O=2Fe2++SO42-+4H+I、Ⅲ
【解析】
(1)在加热的条件下二氧化锰氧化浓盐酸生成氯气,所以甲中发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;正确答案:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑;正确答案:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
(2)应用70%的硫酸中c(H+)比98%的硫酸中c(H+)大,氢离子浓度大反应速率快;正确答案:70%的硫酸中c(H+)比98%的硫酸大。
(3)铁离子具有氧化性,能把SO2氧化生成硫酸,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;正确答案:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
(4)步骤3溶液中含有铁离子生成,说明氯气把亚铁离子氧化生成铁离子。根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性是氯气强于铁离子;I组实验中既有Fe3+又有Fe2+,这说明氯气不足。因此能与SO2反应的只有铁离子。由于步骤5溶液中含有SO42-,这说明铁离子把SO2氧化生成了硫酸,因此氧化性是铁离子强于SO2,I正确;Ⅱ组实验中有Fe3+无Fe2+,因此不能排除氯气是否过量。实验即使步骤5溶液中含有SO42-,也不能说明是被铁离子氧化的,所以无法证明氧化性是铁离子强于SO2。Ⅲ组实验中有Fe3+无Fe2+,虽然不能说明氯气是否过量,但由于在步骤5溶液中含有亚铁离子,这说明在反应中铁离子被SO2还原,所以可以证明氧化性是铁离子强于SO2,答案选I、Ⅲ;正确选项I、Ⅲ。

【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)