题目内容
10.已知甲醛、乙酸和丙酸混合物中,含氧的质量分数为48%,则含碳的质量分数为( )| A. | 55.43% | B. | 44.57% | C. | 40% | D. | 49% |
分析 甲醛(CH2O)、乙醛(C2H4O2)、丙酸(C3H6O2)组成的混合物中,C、H两种元素的原子个数始终是1:2,故混合物C、H两元素的质量之比=12:2=6:1,根据氧元素质量计算C、H元素的总质量分数,进而计算碳元素质量分数.
解答 解:甲醛(CH2O)、乙醛(C2H4O2)、丙酸(C3H6O2)组成的混合物中,C、H两种元素的原子个数始终是1:2,故混合物C、H两元素的质量之比=12:2=6:1,混合物中氧元素质量分数为48%,则C、H元素的总质量分数为1-48%=52%,则碳的质量分数为52%×$\frac{6}{7}$=44.57%,故选B.
点评 本题考查混合物中元素的质量分数的计算,关键是利用各组分的分子式确定C、H的固定组成,难度中等,侧重考查学生的思维能力.

练习册系列答案
相关题目
20.下列各组的三种元素,属于同一周期的是( )
| A. | C、H、O | B. | Li、Na、K | C. | F、Cl、Br | D. | Si、P、S |
1.下列叙述正确的是( )
| A. | 硫酸钡难溶于水,故硫酸钡为弱电解质 | |
| B. | 石墨虽能导电,但不是电解质,而是非电解质 | |
| C. | 反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| D. | 所有的放热反应都能在常温常压下自发进行 |
18.宋代著名法医学家宋慈 的《洗冤集录》中有-银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )
| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
15.300ml 0.01mol/L的FeCl3溶液与200mL 0.06mol/L的KCl溶液中,所含Cl-的物质的量浓度之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
 .为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.
.为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.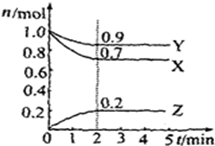 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析: