题目内容
【题目】农业对化肥的需求是合成氨工业发展的持久推动力。在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
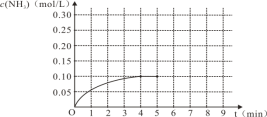
(1)N2(g)+3H2(g)![]() 2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
(2)该温度下,反应N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
其平衡常数K与温度T的关系如下表:
T/℃ | 25 | 125 | 225 |
平衡常数K | 4×106 | K1 | K2 |
试判断K1______ K2(填写“>”“=”或“<”)。原因是_________________________________
(3)下列能说明合成氨反应已达到平衡状态的是________(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2) b. ![]() 不发生变化 c.混合气体的密度保持不变
不发生变化 c.混合气体的密度保持不变
d.25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式并标出电子转移的方向和数目:____________;该反应中氧化产物与还原产物的物质的量之比为____。
(5) pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”)
【答案】0.0125mol/L![]() min K=
min K=![]() > 正反应方向为放热反应,温度升高,平衡逆向移动,K值减小 bd
> 正反应方向为放热反应,温度升高,平衡逆向移动,K值减小 bd 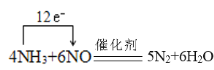 2:3 >
2:3 >
【解析】
(1)图象得知,反应到平衡时, 生成氨气的物质的量浓度为0.10 mol/L,根据公式![]() 计算氨气的化学反应速率,再根据化学计量数之比等于各物质的反应速率之比得出结论;
计算氨气的化学反应速率,再根据化学计量数之比等于各物质的反应速率之比得出结论;
(2)平衡常数K=生成物平衡浓度幂次方乘积与反应物平衡浓度幂次方乘积的比值;反应为放热反应,升温平衡向吸热反应方向进行;
(3)可逆反应到达平衡时,同一物质的正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,注意判断平衡状态的物理量应随反应进行而变化,该物理量由变化到不变化,说明反应到达平衡;
(4)
(5)稀释后两种溶液的pH同,则溶液中c(OH-)相等,根据加水稀释时溶液中n(OH-)变化确定稀释后溶液体积的相对大小。
(1)根据图像可知,反应达到平衡,所需的时间为4min,此时生成氨气的物质的量浓度0.10mol/L,![]() =0.025 mol/L
=0.025 mol/L![]() min,根据化学方程式N2(g)+3H2(g)
min,根据化学方程式N2(g)+3H2(g)![]() 2NH3(g)可知,
2NH3(g)可知,![]() = 0.0125 mol/L
= 0.0125 mol/L![]() min
min
(2)该温度下,反应N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=
2NH3(g)+ Q(Q>0)的平衡常数表达式K=![]() ,反应为放热反应,升温平衡逆向进行,平衡常数减小,则K1>K2,
,反应为放热反应,升温平衡逆向进行,平衡常数减小,则K1>K2,
故答案为:K=![]() ;>;正反应方向为放热反应,温度升高,平衡逆向移动,K值减小;
;>;正反应方向为放热反应,温度升高,平衡逆向移动,K值减小;
(3)a. 不同物质的正、逆反应速率之比等于其计量数之比是平衡状态,3v(N2)=v(H2),不能说明正逆反应速率相同,不能说明反应达到平衡状态,a项错误;
b. ![]() 不发生变化,可K值不变,即温度保持不变,则能说明该反应达平衡状态,b项正确;
不发生变化,可K值不变,即温度保持不变,则能说明该反应达平衡状态,b项正确;
c. 如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,c项错误;
d. 25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,计算此时浓度商Qc=![]() =4×106=K,反应处于平衡状态,d项正确;
=4×106=K,反应处于平衡状态,d项正确;
故答案为:bd;
(4)NH3可用来消除NO的污染,生成2种对环境无害的物质,应生成氮气和水,反应的方程式为 ,反应中只有N元素化合价发生变化,由方程式可以知道反应中氧化产物与还原产物的物质的量之比为4:6=2:3,故答案为:
,反应中只有N元素化合价发生变化,由方程式可以知道反应中氧化产物与还原产物的物质的量之比为4:6=2:3,故答案为: ;2:3;
;2:3;
(5)一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释过程中,促进氨水电离,导致氨水中n(OH)增大,而氢氧化钠中n(OH)不变,要使稀后两种溶液的pH同,则溶液体积关系为:氨水>氢氧化钠,所以m>n,故答案为:>。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案