题目内容
11.在一个密闭容器中进行如下反应:2X2(g)+Y2(g)?2Z(g),反应过程中某一时刻X2、Y2、Z的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.当反应达到平衡时,下列数据可能合理的是( )| A. | Z的浓度为0.4 mol•L-1 | B. | X2、Z的浓度均为0.15 mol•L-1 | ||
| C. | X2与Z的浓度之和为0.4 mol•L-1 | D. | X2的浓度为0.4 mol•L-1 |
分析 可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物不可能100%地全部转化为生成物;
全部转到一边,求算各物质浓度的取值范围,依此得出正确结论,
某一时刻X2、Y2、Z的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.
2X2(g)+Y2(g)?2Z(g),
0.2 0.1 0.2
正向转化 0 0 0.4
逆向转化 0.4 0.2 0
Z全部转化时,X2的物质的量浓度为:0.2mol/L+0.2mol/L=0.4•L-1,Y2的物质的量浓度为:0.1mol/L+0.1mol/L=0.2mol•L-1,
故c(X2)的取值范围为:0.2mol/L<c(X2)<0.4 mol•L-1;
当X2全部转化时,Z的物质的量浓度为:0.2mol/L+0.2mol/L=0.4mol•L-1,
Y2的物质的量浓度为:0
故c(Y2)的取值范围为:0<c(Y2)<0.2mol•L-1,c(Z)的取值范围为:0.2mol/L<c(Z)<0.4 mol•L-1.
解答 解:某一时刻X2、Y2、Z的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.
2X2(g)+Y2(g)?2Z(g),
0.2 0.1 0.2
正向转化 0 0 0.4
逆向转化 0.4 0.2 0
Z全部转化时,X2的物质的量浓度为:0.2mol/L+0.2mol/L=0.4•L-1,Y2的物质的量浓度为:0.1mol/L+0.1mol/L=0.2mol•L-1,
故c(X2)的取值范围为:0.2mol/L<c(X2)<0.4 mol•L-1;
当X2全部转化时,Z的物质的量浓度为:0.2mol/L+0.2mol/L=0.4mol•L-1,
Y2的物质的量浓度为:0
故c(Y2)的取值范围为:0<c(Y2)<0.2mol•L-1,c(Z)的取值范围为:0.2mol/L<c(Z)<0.4 mol•L-1,
A.c(Z)的取值范围为:0.2mol/L<c(Z)<0.4 mol•L-1,故A错误;
B、若X2、Z的浓度均为0.15 mol•L-1,反应正向进行,则反应的X2浓度0.05mol/L,生成Z浓度为0.05mol/L,则Z平衡浓度可以为0.25mol/L,故B错误;
C、若X2与Z的浓度之和为0.4 mol•L-1,X2Z的浓度分别为0.2mol/L,则正向解逆向进行,二者浓度之和均为0.4mol/L,故C正确;
D.c(X2)的取值范围为:0.2mol/L<c(X2)<0.4 mol•L-1,故D错误,
故选C.
点评 本题考查可逆反应的特点,要注意对于可逆反应,反应物不可能100%地全部转化为生成物,掌握方向方法是解题关键,题目难度中等.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 整个过程中的还原剂只有I2 | |
| B. | CCl4层由紫色变成无色的化学反应方程式为:I2+5Cl2+6H2O=2HIO3+10HCl | |
| C. | 若用KI和Cl2反应制1molKIO3,至少需要56LCl2(标准状况) | |
| D. | 把 KI换成NBr,则CCl4层变为红棕色.继续滴加氯水,CCl4层的颜色没有变化,则Cl2、HIO3、HBrO3氧化性由弱到强的顺序是:HBrO3<Cl2<HIO3 |
①废旧报纸
②废铜钱
③一次性塑料盒
④口香糖渣
⑤果皮
⑥空矿泉水瓶
⑦废铁锅.
| A. | ①③⑤⑦ | B. | ③④⑤⑥ | C. | ①②⑤⑦ | D. | ①②⑥⑦ |
| A. | 0.1mo1•L-1MgCl2溶液中含C1一数为0.2 NA | |
| B. | 标准状况下,22.4L的CCl4中含CCl4分子数为NA | |
| C. | 0.1molNa2O2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10mL5mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的.TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+.
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
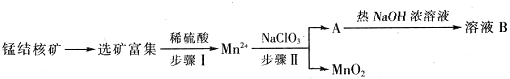
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是氧化亚铁离子.
(2)设计实验证明炉渣中含有FeO取炉渣少许,用稀硫酸浸取后的溶液使KMnO4溶液褪色.
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
| A. |  铜的冶炼 | B. | 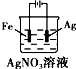 铁上镀银 | C. |  防止Fe被腐蚀 | D. |  构成铜锌原电池 |
| A. | 工业制取硝酸时尾气用氢氧化钠溶液吸收 | |
| B. | 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻到安全区域 | |
| C. | 家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体 | |
| D. | 家中发生天然气泄露时,应立即使用室内电话报警 |
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| C. | 酒精灯着火时可用沙子扑灭 | |
| D. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |