题目内容
下列反应达到平衡后,升高温度可以使混合气体平均相对分子质量增大的是( )
A.H2(g)+I2(g)  2HI(g) ΔH<0 2HI(g) ΔH<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
C.N2(g)+3H2(g)  2NH3(g)ΔH<0 2NH3(g)ΔH<0 |
D.2SO3(g) 2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
B
解析试题分析:A.混合气体的总质量不变,总的物质的量不变,平均相对分子质量始终不变,A不符合;B.混合气体的总质量不变,温度升高平衡向逆反应方向移动,混合气体总的物质的量减小,平均相对分子质量增大,B符合;C.混合气体的总质量不变,温度升高平衡向逆反应方向移动,混合气体总的物质的量增大,平均相对分子质量减小,C不符合;D.混合气体的总质量不变,温度升高平衡向逆反应正反应方向移动,混合气体总的物质的量增大,平均相对分子质量减小,D不符合;选B.
考点:化学平衡的影响因素

练习册系列答案
相关题目
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A..反应在前50 s的平均速率为v(PCl3)="0.0032" mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)="0.11" mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
某学习小组为了探究 BrO3-+5Br-+6H+=3Br2 +3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:zxxk
 实验编号 实验编号相关数据 | ① | ② | ③ | ④ | ⑤ |
| c(H+)/ mol · L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
| c(BrO3-)/ mol· L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
| c(Br-)/ mol· L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
| v / mol· L-1· s-1 | 2.4×10-8 | 4.8×10-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论不正确的是
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v ="k" ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c =2
D.实验⑤中,v1 =4.8×10-8 mol· L-1· s-1
用铁片与0.1mol/L硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是
| A.改用98%浓硫酸 | B.加热 |
| C.改用2mol/L硫酸 | D.把铁片换成铁粉 |
决定化学反应速率的主要因素是
| A.反应物的浓度 | B.反应温度 | C.使用催化剂 | D.反应物的性质 |
一定温度下,可逆反应 A2(g)+3B2(g)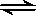 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.容器内A2、B2、AB3的物质的量之比为1:3:2 |
| D.容器内A2、B2、AB3的物质的量浓度相等 |
在容积恒定的密闭容器中,一定量的SO2与1.1molO2发生反应:

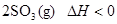 。当气体的物质的量减少0.315mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
。当气体的物质的量减少0.315mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
| A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大 |
| B.反应开始时,向容器中通入的SO2的物质的量是0.7mol |
| C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485mol气体 |
一定条件下,C0与H2反应可生成乙醇:2CO+4H2? CH3CH20H+H20。下列关于该反应的说法错误的是
| A.增大CO的浓度能减小反应速率 |
| B.升高体系温度能增大反应速率 |
| C.使用合适的催化剂可增大反应速率 |
| D.若反应在密闭容器中进行,H2和C0不能全部转化为产物 |
己知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如下:
C(g)+D(g)的化学平衡常数和温度的关系如下:
| 温度(℃) | 700 | 800 | 830 | 1000 | 1200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列说法正确的是
A.该反应的化学平衡常数表达式为:
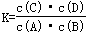
B.该反应为吸热反应
C.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
D.其它条件不变时,增大体系的压强,化学平衡常数减小