题目内容
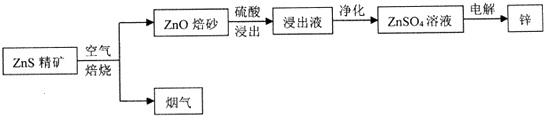
20.工业上用黄铜矿炼铜,其反应如下:8CuFeS2+21O2高温_8Cu+4FeO+2Fe2O3+16SO2Ⅰ.(1)上述冶炼过程产生大量SO2.下列处理方案中合理的是bc(填代号)
a.高空排放 b.用于制备硫酸c.用石灰水吸收 d.用浓硫酸吸收
(2)为了证明产生的SO2气体中是否含CO2气体并验证SO2的漂白性,按如图所示装置,将气体从a端通入,则:

①B中应该装下列B试剂(填编号)
A.NaCl溶液 B.KMnO4溶液 C.盐酸 D.澄清石灰水
②C中品红的作用是:检验二氧化硫是否被除尽
③D中澄清石灰水的作用是:检验是否含CO2
Ⅱ.利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
(1)步骤①中过滤实验所用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(2)步骤②中氧化的目的是将溶液中Fe2+氧化成Fe3+.
(3)验证炉渣中含有FeO,选择的试剂是AC
A.稀硫酸 B.KSCN溶液 C.KMnO4溶液 D.NaOH溶液.
分析 I.(1)二氧化硫有毒,会导致酸雨,直接排放会污染空气,可以用于制备硫酸,二氧化硫属于酸性氧化物,能被碱性溶液吸收;
(2)检验SO2用品红溶液,品红溶液褪色说明含有SO2;检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2,由于SO2与石灰水反应也生成白色沉淀,会影响CO2的检验,故先检验SO2,后检验CO2,检验CO2之前用试剂SO2除去,但选择试剂不能吸收CO2,不能引入CO2,再经过品红溶液判断二氧化硫是否除尽;
Ⅱ.(1)过滤用到的玻璃仪器有:漏斗、烧杯、玻璃棒;
(2)加入氧化剂,将溶液中Fe2+氧化成Fe3+;
(3)FeO与硫酸反应生成硫酸亚铁,再滴入酸性高锰酸钾溶液,溶液紫色褪去,可以检验FeO存在.
解答 解:I.(1)二氧化硫有毒,会导致酸雨,直接排放会污染空气,可以用于制备硫酸,二氧化硫属于酸性氧化物,能被碱性物质吸收,所以可以用石灰水吸收,故选:bc;
(2)检验SO2用品红溶液,品红溶液褪色说明含有SO2;检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2,由于SO2与石灰水反应也生成白色沉淀,会影响CO2的检验,故先检验SO2,后检验CO2,检验CO2之前用试剂SO2除去,但选择试剂不能吸收CO2,不能引入CO2,再经过品红溶液判断二氧化硫是否除尽.
①装置B的作用是除去SO2,防止影响CO2检验,选择试剂吸收二氧化硫,不能吸收CO2,不能引入CO2,
A.氢氧化钠溶液与二氧化碳、二氧化硫都反应,故A错误;
B.酸性高锰酸钾溶液氧化二氧化硫为硫酸,不吸收二氧化碳,故B正确;
C.盐酸不能和二氧化硫、二氧化碳反应,不能吸收二氧化硫,故C错误;
D.澄清石灰水和二氧化碳、二氧化硫都能反应,故D错误;
故答案为:B;
②装置C是检验二氧化硫是否被B吸收彻底的,
故答案为:检验二氧化硫是否被除尽;
③D中澄清石灰水的作用是:检验是否含CO2,
故答案为:检验是否含CO2;
Ⅱ.(1)过滤用到的玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)加入氧化剂,目的是将溶液中Fe2+氧化成Fe3+,
故答案为:将溶液中Fe2+氧化成Fe3+;
(3)FeO与硫酸反应生成硫酸亚铁,亚铁离子具有还原性,再滴入酸性高锰酸钾溶液,溶液紫色褪去,可以检验FeO存在,故选:AC.
点评 本题考查物质的制备与检验、对实验装置的理解、对操作与试剂的分析评价、尾气处理等,有利于培养学生的分析理解能力及化学实验能力.

| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ | |
| D. | 加入氨水直至氨水过量,先产生白色沉淀,后沉淀消失,一定有Al3+ |
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |

已知:2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O.

(2)已知:TiO2+易水解,只能存在于强酸性溶液中.25℃时,难溶电解质溶解度(s)与pH关系如图1,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
②TiO2+水解的离子方程式为TiO2++2H2O?TiO(OH)2+2H+.
向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,促进TiO2+水解.当溶液pH接近3时,TiO(OH)2已沉淀完全.
(3)TiCl4Mg→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
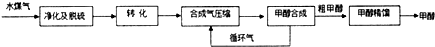
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+32O2 (g)?CO(g)+2H2O (g)△H=-519KJ•mol-1.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ•mol-1.T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•(L•min)-1.
(3)生产过程中,合成气要进行循环,其目的是提高原料CO、H2的利用率(或提高产量、产率亦可);.
(4)下图1为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.

E为该燃料电池的负极极(填“正”或“负”).F电极上的电极反应式为ClO-+2e-+H2O═Cl-+2OH-.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①在N电极上乙二酸生成乙醛酸的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
②若有2molH+通过质子交换膜完全参与反应,则生成的乙醛酸为2mol.
| A. | 物理变化 | B. | 化学变化 | C. | 化合反应 | D. | 分解反应 |