题目内容
15.湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程.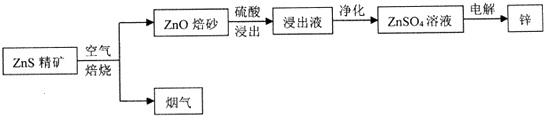
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为H2SO4
(2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质,会影响锌的电解,必须除去.净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的试剂为C(填字母)
A.NaOH B.NH3•H2O C.ZnO D.H2SO4
③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一?2AgCl+SO42-,室温下该反应的平衡常数K=1.5×1015[已知室温下Ksp(Ag2SO4)=6.0x 10-5,Ksp(AgCl)=2.0x 10-10]
(3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在阴极析出,阳极反应式为2H2O-4e-=O2↑+4H+ (或4OH--4e-=O2↑+2H2O).
分析 硫化锌精矿焙烧得到ZnO及烟气,烟气中含有二氧化硫,ZnO焙砂用硫酸酸浸,浸出液中含有ZnSO4等,净化后得到硫酸锌溶液,再电解得到Zn.
(1)烟气中含有二氧化硫,可以制备硫酸;
(2)①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,由电荷守恒,有氢离子参加反应,过氧化氢还原为水;
②选择的试剂能消耗氢离子,且不能引入新杂质;
④溶解平衡分别为:①Ag2SO4(s)?2Ag++SO42-,②AgCl(s)?Ag++Cl-,①-②×2可得:Ag2SO4+2Cl-?2AgCl+SO42-,故室温下该反应的平衡常数K=$\frac{Ksp(A{g}_{2}S{O}_{4})}{[Ksp(AgCl)]^{2}}$;
(3)Zn2+发生还原反应得到Zn,在阴极析出,阳极是溶液中氢氧根离子放电生成氧气.
解答 解:硫化锌精矿焙烧得到ZnO及烟气,烟气中含有二氧化硫,ZnO焙砂用硫酸酸浸,浸出液中含有ZnSO4等,净化后得到硫酸锌溶液,再电解得到Zn.
(1)烟气中含有二氧化硫,可以制备硫酸,故答案为:H2SO4;
(2)①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,由电荷守恒,有氢离子参加反应,过氧化氢还原为水,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②选择的试剂能消耗氢离子,且不能引入新杂质,加入硫酸不能消耗溶液中氢离子,NaOH、NH3•H2O、ZnO 均能消耗溶液中氢离子,但NaOH、NH3•H2O 会引入杂质离子,故选:C;
④溶解平衡分别为:①Ag2SO4(s)?2Ag++SO42-,②AgCl(s)?Ag++Cl-,①-②×2可得:Ag2SO4+2Cl-?2AgCl+SO42-,故室温下该反应的平衡常数K=$\frac{Ksp(A{g}_{2}S{O}_{4})}{[Ksp(AgCl)]^{2}}$=$\frac{6.0×1{0}^{-5}}{(2.0×1{0}^{-10})^{2}}$=1.5×1015,
故答案为:1.5×1015;
(3)Zn2+发生还原反应得到Zn,在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,阳极电极反应式为:2H2O-4e-=O2↑+4H+ (或 4OH--4e-=O2↑+2H2O),
故答案为:阴;2H2O-4e-=O2↑+4H+ (或 4OH--4e-=O2↑+2H2O).
点评 本题考查物质制备工艺流程、物质的分离提纯、对操作的分析评价、溶度积有关计算、电解原理等,(2)中④可以用溶度积表示氯离子、硫酸根的浓度,再进行平衡常数计算.

| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 1,2,4-三甲基-1-丁醇 |

已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是( )
| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
| A. | 羟基的电子式 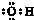 | B. | 醛基的结构简式-COH | ||
| C. | 1-丁烯的键线式  | D. | 聚丙烯的结构简式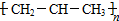 |
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 第一电离能呈周期性变化 |
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( ) 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
