题目内容
8.多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2•2H2O,工艺流程如下:
已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4;
②BaCO3的相对分子质量是197; BaCl2•2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式SiCl4+4H2O=H4SiO4↓+4HCl.
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
(3)加钡矿粉调节pH=7的作用是:①使BaCO3转化为BaCl2②使Fe3+离子沉淀完全
(4)生成滤渣A的离子方程式Mg2++2OH-=Mg(OH)2↓
(5)BaCl2滤液经蒸发浓缩、冷却结晶、过滤、洗涤,再经真空干燥后得到BaCl2•2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2•2H2O9.76吨.
分析 四氯化硅控制温度40°C,加入水过滤得到原硅酸,则发生水解反应生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁沉淀,过滤得到滤液为氯化钡溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等得到氯化钡晶体.
(1)四氯化硅水解生成原硅酸和氯化氢;
(2)由题目信息可知,SiCl4蒸汽与NH3在高温条件下得到Si3N4,同时生成HCl;
(3)由pH=3.4时,Fe3+离子转化为氢氧化铁,当调节PH=7时能促使Fe3+离子沉淀完全;
(4)滤液②中加入NaOH溶液调节溶液pH=12.5,溶液中镁离子与氢氧根离子反应生成氢氧化镁沉淀;
(5)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等;
(6)根据Ba元素质量守恒计算m(BaCl2•2H2O).
解答 解:四氯化硅控制温度40°C,加入水过滤得到原硅酸,则发生水解反应生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁沉淀,过滤得到滤液为氯化钡溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等得到氯化钡晶体.
(1)四氯化硅水解生成原硅酸和氯化氢,反应方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(2)由题目信息可知,SiCl4蒸汽与NH3在高温条件下得到Si3N4,同时生成HCl,化学方程式为:3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,
故答案为:3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
(3)由pH=3.4时,Fe3+离子转化为氢氧化铁,当调节PH=7时能促使Fe3+离子沉淀完全,盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2,使Fe3+离子沉淀完全,
故答案为:使Fe3+离子沉淀完全;
(4)滤液②中加入NaOH溶液调节溶液pH=12.5,溶液中镁离子与氢氧根离子反应生成氢氧化镁沉淀,反应离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;
(5)BaCl2滤液经蒸发浓缩、冷却结晶、过滤、洗涤,再经真空干燥后得到BaCl2•2H2O,故答案为:蒸发浓缩、冷却结晶;
(6)根据Ba元素质量守恒:n(BaCl2•2H2O)=n(BaCO3),则m(BaCl2•2H2O)×=n(BaCl2•2H2O)×M(BaCl2•2H2O)=$\frac{10t×78%}{197g/mol}$×244g/mol=9.76t,
故答案为:9.76.
点评 本题考查制备实验方案、物质分离和提纯、对条件控制分析与评价、化学计算等,充分考查了学生的分析、理解能力及知识迁移运用的能力,难度中等.

| A. | CH3CH2OCH3 | B. | CH3CH(OH)CH3 | C. | CH3CH2CH2OH | D. | CH3CH2CHO |
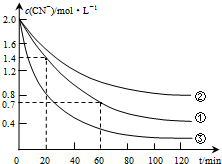 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l) 请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
| A. | 第一电离能越大的原子越容易得到电子 | |
| B. | 同周期元素从左到右第一电离能一定增大 | |
| C. | 同周期元素电负性从左到右越来越大 | |
| D. | 金属元素的电负性一定小于非金属元素 |

 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
