题目内容
9.有A、B、C、D四种元素,最高正价依次为1、4、5、7,其核电荷数按B、C、D、A顺序增 大.已知B的次外层电子数为2,C、D、A原子次外层电子数均为8,C、D原子的电子层数相同,A原子的核外电子数不超过20,则A为K,B为C,C为P,D为Cl.(用化学式表示)分析 B的次外层电子数为2,能够形成最高正价为+4,则B为C元素;C、D、A原子次外层电子数均为8,则C、D、A处于第三或四周期,核电荷数按B、C、D、A顺序增大,且A的最高化合价为+1,则A处于第四周期,为K元素;C、D只能处于第二周期,C最高正价为+5,则C为P元素;D最高正价为+7,则D为Cl元素,据此进行解答.
解答 解:B的次外层电子数为2,能够形成最高正价为+4,则B为C元素;C、D、A原子次外层电子数均为8,则C、D、A处于第三或四周期,核电荷数按B、C、D、A顺序增大,且A的最高化合价为+1,则A处于第四周期,为K元素;C、D只能处于第二周期,C最高正价为+5,则C为P元素;D最高正价为+7,则D为Cl元素,
根据分析可知,A为K、B为C、C为P、D为Cl,
故答案为:K;C;P;Cl.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,明确原子结构与元素周期表、元素周期律的关系为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.某烃1体积只能与1体积氯气发生加成反应,生成氯代烷烃,此氯代烷烃1mol可与4mol氯气发生完全的取代反应,则该烃的结构简式为( )
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
4.下列表述正确的是( )
| A. | 羟基的电子式 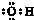 | B. | 醛基的结构简式-COH | ||
| C. | 1-丁烯的键线式  | D. | 聚丙烯的结构简式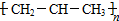 |
1.下列化合物沸点比较错误的是( )
| A. | 丁烷>乙烷>甲烷 | B. | 1-氯戊烷<1-氯丙烷 | ||
| C. | 一氯乙烷>一氟乙烷 | D. | 正戊烷>异戊烷>新戊烷 |
18.下列有关说法中正确的是( )
| A. | 第一电离能越大的原子越容易得到电子 | |
| B. | 同周期元素从左到右第一电离能一定增大 | |
| C. | 同周期元素电负性从左到右越来越大 | |
| D. | 金属元素的电负性一定小于非金属元素 |


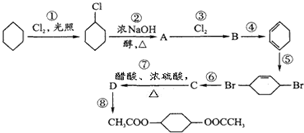 从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去):
从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去): ,C
,C ,D
,D .
.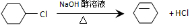 ;
; ;
; .
. 短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题
短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题