题目内容
【题目】常温下,某同学将盐酸与氨水等体积混合,混合前两种溶液的浓度和混合后所得溶液的pH如下表。据表分析,下列说法正确的是( )
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
A.②中,c=0.2
B.①、③所得溶液中的![]() :①>③
:①>③
C.③中所得溶液中c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
D.①中所得混合溶液,由水电离出的c(H+)=1×10-9 mol·L-1
【答案】B
【解析】
A、由于是等体积混合,若c=0.2,则意味着n(NH3·H2O)=n(HCl),则②中所得溶液的溶质只有NH4Cl,此时溶液呈酸性,若溶液pH=7,则需要NH3·H2O过量,即c>0.2,A错误;
B、![]() =
=![]() =
=![]() ,从表中的数据可以看出,c(H+)1> c(H+)3,K和Kw常温下是常数,故①、③所得溶液中的
,从表中的数据可以看出,c(H+)1> c(H+)3,K和Kw常温下是常数,故①、③所得溶液中的![]() :①>③,B正确;
:①>③,B正确;
C、③中所得溶液有电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),物料守恒:c(NH4+)+c(NH3·H2O)=2c(Cl-),则有:c(NH4+)+2c(H+)=2c(OH-)+c(NH3·H2O),C错误;
D、①中所得溶液的溶质为NH4Cl,则溶液中的H+全部来自于水的电离,即水电离出的c(H+)=1×10-5mol·L-1,D错误;
故选B。

【题目】下列实验操作和过程可以达到实验目的的是
选项 | 实验目的 | 实验操作和过程 |
A | 取20.00 mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸全部放入锥形瓶 |
B | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
C | 探究铁的吸氧腐蚀 | 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中
|
D | 证明 Ksp(CuS)<Ksp(ZnS) | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 |
A.AB.BC.CD.D
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
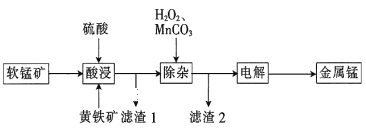
已知相关金属离子[c(Mn+)=0.1molL-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:___。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是___(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是___,该过程需调节溶液pH的范围是___,若把pH调得过高,除了会使锰的产率会降低,其后果还有___。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为___,电解后阳极的电解质溶液可返回___(填“酸浸”“除杂”或“电解”)工序继续使用。
【题目】常温下,浓度均为0.1mol·L-1的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7;Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)①中各离子浓度由大到小的顺序是___。
(2)④的水解平衡常数Kh=___。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③___④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:__。