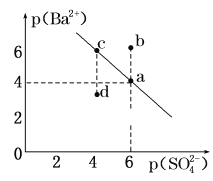
МвДҝДЪИЭ
ЎҫМвДҝЎҝіЈОВПВЈ¬ЕЁ¶ИҫщОӘ0.1molЎӨL-1өДПВБР4ЦЦИЬТәЈә
ўЩNaCNИЬТә ўЪNaOHИЬТә ўЫCH3COONaИЬТә ўЬNaHCO3ИЬТә
HCN | H2CO3 | CH3COOH |
Ka=4.9ЎБ10-10 | Ka1=4ЎБ10-7Ј»Ka2=5.6ЎБ10-11 | Ka=1.7ЎБ10-5 |
ЈЁ1Ј©ўЩЦРёчАлЧУЕЁ¶ИУЙҙуөҪРЎөДЛіРтКЗ___ЎЈ
ЈЁ2Ј©ўЬөДЛ®ҪвЖҪәвіЈКэKh=___ЎЈ
ЈЁ3Ј©ИфПтөИМе»эөДўЫәНўЬЦРөОјУСОЛбЦБіКЦРРФЈ¬ФтПыәДСОЛбөДМе»эўЫ___ўЬ(МоЎ°>ЎұЎўЎ°<"ЎўЎ°=Ўұ)
ЈЁ4Ј©ПтNaCNИЬТәЦРНЁИлЙЩБҝCO2Ј¬Фт·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә__ЎЈ
Ўҫҙр°ёЎҝc(NaЈ«)Јҫc(CN-)Јҫc(OH-)Јҫc(HЈ«) 2.5ЎБ10-8 Јј CN-Ј«CO2Ј«H2OЈҪHCNЈ«HCO3-
ЎҫҪвОцЎҝ
ЈЁ1Ј©ёщҫЭұнЦРөДКэҫЭҝЙЦӘЈ¬NaCNИЬТәЦРҙжФЪCN-өДЛ®ҪвЖҪәвЈ¬ФтўЩЦРёчАлЧУЕЁ¶ИУЙҙуөҪРЎөДЛіРтОӘc(NaЈ«)Јҫc(CN-)Јҫc(OH-)Јҫc(HЈ«)Ј»
ЈЁ2Ј©ФЪNaHCO3ИЬТәЦРЈ¬Л®ҪвЖҪәвОӘHCO3-+H2O![]() H2CO3+OH-Ј¬ФтKb=
H2CO3+OH-Ј¬ФтKb=![]() =
=![]() =2.5ЎБ10-8Ј»
=2.5ЎБ10-8Ј»
ЈЁ3Ј©Kb(CH3COOH)=![]() =
=![]() =5.9ЎБ10-10Ј¬Kb(HCO3-)=2.5ЎБ10-8Ј¬ФтCH3COONaЎўNaHCO3ҫщҝЙҝҙЧчТ»ФӘИхјоЈ¬ЗТNaHCO3өДјоРФҪПЗҝЈ¬ИфПтөИМе»эЎўөИЕЁ¶ИөДўЫәНўЬЦРөОјУСОЛбЦБіКЦРРФЈ¬ПыәДСОЛбөДМе»эўЫ<ўЬЈ»
=5.9ЎБ10-10Ј¬Kb(HCO3-)=2.5ЎБ10-8Ј¬ФтCH3COONaЎўNaHCO3ҫщҝЙҝҙЧчТ»ФӘИхјоЈ¬ЗТNaHCO3өДјоРФҪПЗҝЈ¬ИфПтөИМе»эЎўөИЕЁ¶ИөДўЫәНўЬЦРөОјУСОЛбЦБіКЦРРФЈ¬ПыәДСОЛбөДМе»эўЫ<ўЬЈ»
ЈЁ4Ј©УЙУЪKa2(H2CO3)<Ka(HCN)< Ka1(H2CO3)Ј¬ПтNaCNИЬТәЦРНЁИлЙЩБҝCO2Ј¬·ўЙъ·ҙУҰөДАлЧУ·ҙУҰЈәCN-+CO2+H2O=HCN+HCO3-ЎЈ

ЎҫМвДҝЎҝіЈОВПВЈ¬ДіН¬С§Ҫ«СОЛбУл°ұЛ®өИМе»э»мәПЈ¬»мәПЗ°БҪЦЦИЬТәөДЕЁ¶ИәН»мәПәуЛщөГИЬТәөДpHИзПВұнЎЈҫЭұн·ЦОцЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
КөСйұаәЕ | °ұЛ®ЕЁ¶И/molЎӨLЈӯ1 | СОЛбЕЁ¶И/molЎӨLЈӯ1 | »мәПИЬТәpH |
ўЩ | 0.1 | 0.1 | pHЈҪ5 |
ўЪ | c | 0.2 | pHЈҪ7 |
ўЫ | 0.2 | 0.1 | pHЈҫ7 |
A.ўЪЦРЈ¬cЈҪ0.2
B.ўЩЎўўЫЛщөГИЬТәЦРөД![]() ЈәўЩ>ўЫ
ЈәўЩ>ўЫ
C.ўЫЦРЛщөГИЬТәЦРc(NH4+)+c(H+)ЈҪc(OHЈӯ)+c(NH3ЎӨH2OЈ©
D.ўЩЦРЛщөГ»мәПИЬТәЈ¬УЙЛ®өзАліцөДc(HЈ«)ЈҪ1ЎБ10Јӯ9 molЎӨLЈӯ1