题目内容
【题目】下列实验操作和过程可以达到实验目的的是
选项 | 实验目的 | 实验操作和过程 |
A | 取20.00 mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸全部放入锥形瓶 |
B | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
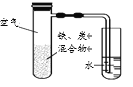
C | 探究铁的吸氧腐蚀 | 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中
|
D | 证明 Ksp(CuS)<Ksp(ZnS) | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 |
A.AB.BC.CD.D
【答案】C
【解析】
A.50mL酸式滴定管的50mL刻度位于活塞的上方,在50mL下方仍有液体,初始读数为30.00mL时,将剩余盐酸全部放入锥形瓶,则体积大于20.00 mL,A错误;
B.NaHSO3+H2O2=NaHSO4+H2O,无现象,无法用此实验探究浓度对反应速率的影响,B 错误;
C.铁粉和活性炭的混合物用NaCl溶液湿润,一段时间后,看到导管内液面上升,则表明反应消耗O2,铁发生吸氧腐蚀,C正确;
D.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,虽然生成黑色CuS沉淀,但不能证明ZnS与Cu2+发生反应,D错误;
故选C。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】常温下,某同学将盐酸与氨水等体积混合,混合前两种溶液的浓度和混合后所得溶液的pH如下表。据表分析,下列说法正确的是( )
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
A.②中,c=0.2
B.①、③所得溶液中的![]() :①>③
:①>③
C.③中所得溶液中c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
D.①中所得混合溶液,由水电离出的c(H+)=1×10-9 mol·L-1