题目内容
20.SiO2,H2SO4,NH3,NaCl是中学化学中常见的化合物,他们在生产、生活中有着广泛的应用,请回答下列问题:(1)Si元素在周期表中的位置是第三周期第ⅣA族,SiO2属于原子晶体.SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为SiCl4+2H2+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+4HCl.
(2)请按熔、沸点从高到低的顺序对上述四种化合物排序SiO2>NaCl>H2SO4>NH3.
(3)H2SO4是一种用途广泛的化学试剂,请写出H2SO4的两种用途催化剂、脱水剂、干燥剂等.
(4)NH3分子间能形成氢键,请用氢键表示式表示氨分子间存在的氢键N-H…N,NaCl的饱和NH3溶液中通入气体X是工业制纯碱的关键反应,请用化学方程式表示该反应NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,工业上电解饱和食盐水能制取多种化工原料,电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
分析 (1)根据Si的原子结构示意图判断在周期表中的位置,SiO2属于原子晶体,SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可;
(2)一般来说,熔沸点高低顺序是:原子晶体、离子晶体、分子晶体;
(3)根据浓硫酸可以作反应的催化剂、脱水剂、干燥剂等判断;
(4)氢键是与N、O、F直接相连的氢与N、O、F之间的一种分子间作用力,用“…”表示;食盐、氨气、水和二氧化碳发生化学反应,生成碳酸氢铵和氯化铵;电解饱和食盐水生成氢气、氯气和氢氧化钠,据此书写方程式.
解答 解:(1)Si的原子核外共有3层,最外层有4个电子,所以在周期表中的位置是第三周期第ⅣA族,SiO2属于原子晶体,SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,发生的化学方程式为:SiCl4+2H2+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+4HCl;
故答案为:第三周期第ⅣA族; 原子;SiCl4+2H2+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+4HCl;
(2)一般来说,熔沸点高低顺序是:原子晶体、离子晶体、分子晶体,二氧化硅属于原子晶体、NaCl属于离子晶体、硫酸和氨气属于分子晶体,但常温下硫酸为液态而氨气为气态,所以硫酸的熔沸点大于氨气,则这几种物质熔沸点高低顺序是SiO2>NaCl>H2SO4>NH3,故答案为:SiO2>NaCl>H2SO4>NH3;
(3)因为浓硫酸可以作反应的催化剂、脱水剂、干燥剂等,所以H2SO4的用途有催化剂、脱水剂、干燥剂等;故答案为:催化剂、脱水剂、干燥剂等;
(4)氢键是与N、O、F直接相连的氢与N、O、F之间的一种分子间作用力,用“…”表示,所以氨分子间存在的氢键为N-H…N;食盐、氨气、水和二氧化碳发生化学反应,生成碳酸氢铵和氯化铵,化学方程式为NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl;电解饱和食盐水生成氢气、氯气和氢氧化钠,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑;故答案为:N-H…N;NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
点评 本题考查了硅及其二氧化硅的性质,熔沸点的比较,氢键的表示方式以及侯氏制碱法的原理,电解原理及离子反应,明确物质的性质是解本题关键,根据物质之间的反应来分析解答即可,题目较为综合,难度中等.

| A. | 三种金属物质的量相等 | B. | 三种金属均过量 | ||
| C. | 三种金属的质量相等 | D. | 盐酸均过量 |
| A. | 在洁净的试管中加入1-2 mL AgNO3溶液,再加入过量浓氨水,振荡,混合均匀 | |
| B. | 在洁净的试管中加入1-2 mL浓氨水,再加入AgNO3溶液至过量 | |
| C. | 在洁净的试管中加入1-2 mL稀氨水,再逐滴加入2%AgNO3溶液至过量 | |
| D. | 在洁净的试管中加入2%AgNO3溶液1-2 mL,逐滴加入2%稀氨水至沉淀恰好溶解为止 |
| A. | 结构简式为 的有机物其名称为 2-丁醇 的有机物其名称为 2-丁醇 | |
| B. | 分子式为C4H8Br2结构中含一个一CH3的同分异构体(不考虑立体异构)有4种 | |
| C. | 某有机物球棍结构模型为: ,则该有机物能发生消去反应和氧化反应 ,则该有机物能发生消去反应和氧化反应 | |
| D. | 二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A. | A | B. | B | C. | C | D. | D |

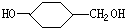 、D
、D ;
;
 .
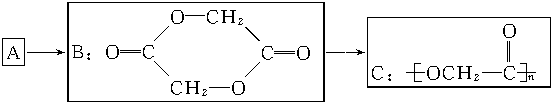
.
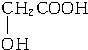 .
. .
.