题目内容
【题目】运用基本公式进行计算:
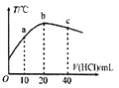
(1)标准状况下,①4g氢气、 ②33.6L甲烷(CH4)、 ③6.02×1024个水分子、④1mol NH3中,
分子数由大到小的顺序为 ____________________(填序号,下同),含氢原子数最多的是_________,体积最大的是____________。
(2)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(混合后体积变化忽略不计),
所得溶液中Cl-的物质的量浓度是_____________________。
(3)已知224L标准状况下的HCl气体完全溶于1L水(密度为1g/cm3)得到密度为1.1g/cm3的盐酸,此盐酸的物质的量浓度为:__________________ (保留一位小数)。
【答案】③>①>②>④③①0.56 mol/L8.1 mol/L
【解析】
(1)①氢气的物质的量为![]() =2mol,②标准状况下甲烷的物质的量为
=2mol,②标准状况下甲烷的物质的量为![]() =1.5mol,③水的物质的量为
=1.5mol,③水的物质的量为![]() =1mol,④NH3物质的量为1mol,显然物质的量越大分子数越大,则,分子数由大到小的顺序为③>①>②>④;含氢原子数分别为2mol×2×NAmol-1=4NA、1.5mol×4×NAmol-1=6NA、1mol×2×NAmol-1=2NA、1mol×3×NAmol-1=3NA,故含氢原子数最多的是③;相同状况下,物质的量越大,气体的体积越大,则体积最大的为①;
=1mol,④NH3物质的量为1mol,显然物质的量越大分子数越大,则,分子数由大到小的顺序为③>①>②>④;含氢原子数分别为2mol×2×NAmol-1=4NA、1.5mol×4×NAmol-1=6NA、1mol×2×NAmol-1=2NA、1mol×3×NAmol-1=3NA,故含氢原子数最多的是③;相同状况下,物质的量越大,气体的体积越大,则体积最大的为①;
(2)所得溶液中Cl-的物质的量为:0.2L×0.3mol/L+0.05L×0.8mol/L×2=0.14mol,所得溶液中Cl-的物质的量浓度是![]() =0.56mol/L;
=0.56mol/L;
(3)224L标准状况下的HCl气体物质的量为![]() ,完全溶于1L水(密度为1g/cm3)得到密度为1.1g/cm3的盐酸,所得溶液的体积为
,完全溶于1L水(密度为1g/cm3)得到密度为1.1g/cm3的盐酸,所得溶液的体积为![]() ,此盐酸的物质的量浓度为:
,此盐酸的物质的量浓度为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有关键能数据如表
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2 kJ·mol-1,则表中x的值为 ( )
A.460B.920
C.1165.2D.423.3
【题目】Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g)![]() 2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
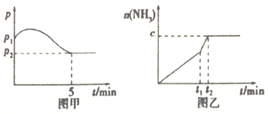
①若图中c=1.6mol,则改变的条件是__________(填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________(填字母);此时该反应的平衡常数__________(填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
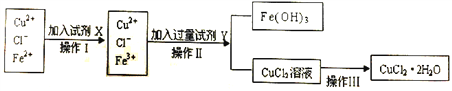
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________(填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________。
【题目】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应后,反应速率最快和最慢的容器编号分别是
容器编号 | 温度 | SO2的物质的量 | O2的物质的量 | 催化剂 |
甲 | 500 ℃ | 10 mol | 5 mol | - |
乙 | 500 ℃ | 10 mol | 5 mol | V2O5 |
丙 | 500 ℃ | 8 mol | 5 mol | - |
丁 | 450 ℃ | 8 mol | 5 mol | - |
A.甲、乙B.甲、丙C.乙、丁D.丙、丁