题目内容
【题目】有5种混合溶液,分别由等体积0.1mol/L的两种溶液混合而成:
(1)CH3COONa与NaHSO4 (2)CH3COONa与NaOH, (3)CH3COONa与NaCl
(4)CH3COONa与NaHCO3 (5)CH3COONa与NaHSO3
下列各项排序正确的是( )
A. pH:(2)>(4)>(5)>(3)>(1) B. c(CH3COOH):(1)>(3)>(5)>(4)>(2)
C. c(CH3COO-):(2)>(3)>(4)>(5)>(1) D. 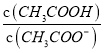 :(1)>(5)>(3)>(4)>(2)
:(1)>(5)>(3)>(4)>(2)
【答案】D
【解析】A、(1)CH3COONa与NaHSO4,溶液显酸性;(2)CH3COONa与NaOH,溶液呈碱性;(3)CH3COONa与NaCl,溶液中醋酸根离子水解显碱性;(4)CH3COONa与NaHCO3,醋酸根离子和碳酸氢根离子水解呈碱性;(5)CH3COONa与NaHSO3 醋酸根离子水解呈碱性,亚硫酸氢根离子电离大于水解显酸性;得到溶液中pH大小为:(2)>(4)>(3)>(5)>(1),故A错误;B、(1)CH3COONa与NaHSO4,溶液显酸性;生成醋酸;(2)CH3COONa与NaOH,溶液呈碱性;氢氧化钠溶液中氢氧根离子抑制醋酸根离子水解;(3)CH3COONa与NaCl,溶液中醋酸根离子水解显碱性;(4)CH3COONa与NaHCO3,醋酸根离子和碳酸氢根离子水解呈碱性,相互抑制;(5)CH3COONa与NaHSO3 醋酸根离子水解呈碱性,亚硫酸氢根离子电离大于水解显酸性;促进醋酸根离子水解;c(CH3COOH)浓度为:(1)>(5)>(3)>(4)>(2),故B错误;C、依据上述分析判断,c(CH3COO-)浓度大小为:(2)>(4)>(3)>(5)>(1);故C错误;D、(1)CH3COONa与NaHSO4,溶液显酸性;生成醋酸;(2)CH3COONa与NaOH,溶液呈碱性;氢氧化钠溶液中氢氧根离子抑制醋酸根离子水解;(3)CH3COONa与NaCl,溶液中醋酸根离子水解显碱性;(4)CH3COONa与NaHCO3,醋酸根离子和碳酸氢根离子水解呈碱性,相互抑制;(5)CH3COONa与NaHSO3 醋酸根离子水解呈碱性,亚硫酸氢根离子电离大于水解显酸性;促进醋酸根离子水解; 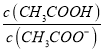 比值大小顺序为:(1)>(5)>(3)>(4)>(2),故D正确;故选D。
比值大小顺序为:(1)>(5)>(3)>(4)>(2),故D正确;故选D。

 计算高手系列答案
计算高手系列答案【题目】Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g)![]() 2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
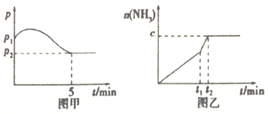
①若图中c=1.6mol,则改变的条件是__________(填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________(填字母);此时该反应的平衡常数__________(填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
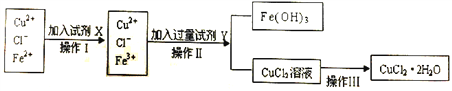
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________(填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________。