题目内容
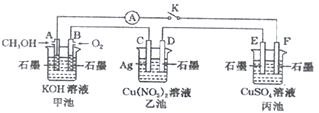
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为_________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______。
(2)丙池中F电极为____(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的方程式为_____。
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是______(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)甲醇和乙醇都可以做燃料。已知乙醇液体完全燃烧生成CO2气体和1mol液态水时放出热量453.3kJ,请写出乙醇燃烧的热化学方程式:____________。
【答案】 原电池 CH3OH+8OH--6e-=CO32-+6H2O 阴极 2CuSO4+2H2O![]() 2H2SO4+2Cu+ O2↑ 224 A C2H5OH(l)+3O2(g)=2CO2(g)+3H2O △H=-1359.9kJ/mol
2H2SO4+2Cu+ O2↑ 224 A C2H5OH(l)+3O2(g)=2CO2(g)+3H2O △H=-1359.9kJ/mol
【解析】(1)甲池为燃料电池,是原电池;A电极的电极是燃料发生氧化反应,反应式为CH3OH+8OH--6e-═CO32-+6H2O,故答案为:原电池;CH3OH+8OH--6e-═CO32-+6H2O;
(2)丙池中F与电源的负极相连是阴极,惰性电极电解硫酸铜生成铜和氧气,电极反应式为:2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑,故答案为:阴极;2CuSO4+2H2O
2H2SO4+2Cu+O2↑,故答案为:阴极;2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑;
2H2SO4+2Cu+O2↑;
(3)根据转移电子数目相等,4Ag~~O2,
4×108g 22400mL
4.32g V
所以![]() =
=![]() ,解之得:V=224mL,故答案为:224;
,解之得:V=224mL,故答案为:224;
(4)甲池为燃料电池,A为负极,B为正极,则乙中C为阳极,D为阴极,阳极上Ag失电子生成银离子,阴极上铜离子得电子生成Cu,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,故选A;
(5)乙醇燃烧生成液态水的化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),生成1mol液态水时放出热量453.3kJ,则生成3mol液态水时放出热量为453.3kJ×3=1359.9kJ,则乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1359.9kJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1359.9kJ/mol。

【题目】Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g)![]() 2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
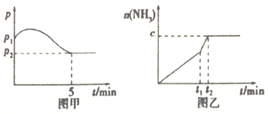
①若图中c=1.6mol,则改变的条件是__________(填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________(填字母);此时该反应的平衡常数__________(填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
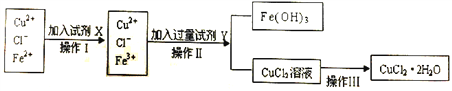
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________(填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________。
【题目】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应后,反应速率最快和最慢的容器编号分别是
容器编号 | 温度 | SO2的物质的量 | O2的物质的量 | 催化剂 |
甲 | 500 ℃ | 10 mol | 5 mol | - |
乙 | 500 ℃ | 10 mol | 5 mol | V2O5 |
丙 | 500 ℃ | 8 mol | 5 mol | - |
丁 | 450 ℃ | 8 mol | 5 mol | - |
A.甲、乙B.甲、丙C.乙、丁D.丙、丁
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:

已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)
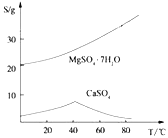
根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。