题目内容
14.(一)、今有几种物质:①乙醇 ②石墨 ③石灰水 ④熔化的KNO3 ⑤纯硫酸 ⑥NH3(填序号)其中,(1)能导电的有②③④,
(2)属于电解质的有④⑤,
(3)既不是电解质也不是非电解质的是②③.
(二)、质量为3.9g的Na2 X中含Na+ 的物质的量为0.1mol,则Na2 X的摩尔质量为78g/mol,X的相对原子质量为32.
分析 (一)(1)石墨可以导电,电解质溶液、熔融的离子化合物可以导电;
(2)电解质是指在水溶液或熔融状态下可以导电的化合物,注意电解质自身电离出自由离子;
(3)单质、混合物既不是电解质也不是非电解质;
(二)根据钠离子物质的量计算3.9g的Na2X的物质的量,根据M=$\frac{m}{M}$计算Na2X的摩尔质量,进而计算X的相对原子质量.
解答 解:(一)①乙醇属于共价化合物,在水溶液中不能电离出离子,不能导电,属于非电解质;
②石墨含有只有移动的电子,可以导电,但属于单质,既不是电解质也不是非电解质;
③石灰水中氢氧化钙电离出钙离子、氢氧根离子,溶液可以导电,但属于混合物,既不是电解质也不是非电解质;
④硝酸钾属于共价化合物,熔化的KNO3电离出钾离子、硝酸根离子,可以导电,属于电解质;
⑤硫酸属于共价化合物,纯硫酸没有自由移动的离子,不能导电,但溶于水可以电离出氢离子与硫酸根离子,属于电解质;
⑥NH3属于共价化合物,溶于水导电,是由于生成的一水合氨电离出铵根离子与氢氧根离子,故氨气属于非电解质,
(1)能导电的有②③④;(2)属于电解质的有④⑤;(3)既不是电解质也不是非电解质的是:②③,
故答案为:②③④;④⑤;②③;
(二)3.9g的Na2X的物质的量为$\frac{0.1mol}{2}$=0.05mol,故Na2X的摩尔质量为$\frac{3.9g}{0.05mol}$=78g/mol,则X的相对原子质量为78-23×2=32,
故答案为:78g/mol;32.
点评 本题考查电解质与非电解质、物质的量有关计算,比较基础,注意对电解质的理解:①属于化合物、②在水溶液或熔融状态下可以导电、③化合物自身电离出自由离子.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
15.下列离子方程式书写正确的是( )
| A. | 钠投入CuSO4溶液中:2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ | |
| B. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
2.下列关于化学键的说法正确的是( )
| A. | 离子化合物中一定存在离子键,可能存在共价键 | |
| B. | 由金属元素和非金属元素组成的化学键一定是共价键 | |
| C. | 非极性键只存在于双原子单质分子中 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
9.下列说法中,正确的是( )
| A. | 1-丁烯和2-丁烯都存在顺反异构现象 | |
| B. | 一氯甲烷不存在同分异构体的事实可以证明甲烷分子是正四面体形分子 | |
| C. | 间二氯苯只有一种结构的事实可以证明苯分子是正六边形分子 | |
| D. | 苯不能使高锰酸钾酸性溶液或溴的四氯化碳溶液褪色可以证明苯分子中的碳碳键完全相同 |
6.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 丙烯(CH2=CH-CH3)和环丙烷组成的42g混合气体中氢原子的个数为6NA |
3.下列实验不能达到目的是( )
| A. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 | |
| B. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 | |
| D. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了反应而成碱性 |
4.下列说法正确的是( )
| A. | 所有物质中均存在化学键 | |
| B. | 非金属元素间形成的化合物一定是共价化合物 | |
| C. | 离子化合物中可能含非极性共价键 | |
| D. | 有共价键的化合物一定是共价化合物 |
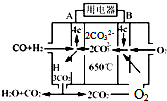 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.