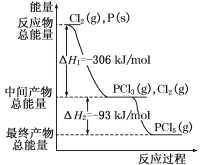
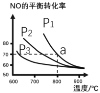
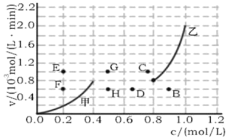
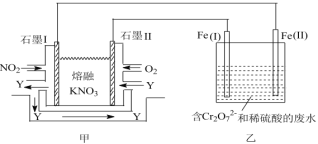
题目内容
【题目】甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH (g) ΔH=a kJ·mol1,在不同温度下,K(500℃)=2.5 L2·mol2,K(700℃)=0.2 L2·mol2。
①ΔH________0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2 mol、1 mol、3mol,则此时生成CH3OH的速率____消耗CH3OH的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
i 2CH3OH(g)=C2H4(g)+2H2O(g) ΔH1=-20.9 kJ·mol1
ii3CH3OH(g)=C3H6(g)+3H2O(g) ΔH2=-98.1 kJ·mol1
iii 4CH3OH(g)=C4H8(g)+4H2O(g) ΔH3=-118.1 kJ·mol1
①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g)![]() 3C2H4 (g) ΔH4=____。
3C2H4 (g) ΔH4=____。
②加入N2作为稀释剂,反应i中C2H4的产率将_____(增大、减小、不变)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:
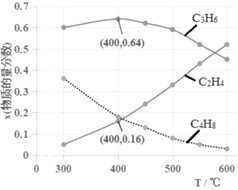
①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是_____________________________;当温度低于400℃时,原因是________________________。
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=________(列式计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为了获得更高的C2H4在产物中的比例,除控制较高温度的条件外,以下较适宜的是______。
A.增加水醇比 B.降低水醇比
【答案】< < +133.5 kJ·mol-1 增大 温度高于400℃时,温度升高,反应iv:2C3H6(g)![]() 3C2H4 (g) ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小 当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大 0.001MPa A
3C2H4 (g) ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小 当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大 0.001MPa A
【解析】
(1)①在不同温度下,K(500℃)=2.5L·mol1,K(700℃)=0.2L·mol1,K(700℃)<K(500℃),说明温度升高有利于向逆反应方向移动,可得ΔH<0。
②500℃时,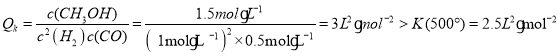 ,此时反应向逆反应方向进行,生成CH3OH的速率小于消耗CH3OH的速率。
,此时反应向逆反应方向进行,生成CH3OH的速率小于消耗CH3OH的速率。
(2)①依据热化学方程式和盖斯定律计算i×3-ii×2得到iv:2C3H6(g)= 3C2H4(g)ΔH4=+133.5 kJ·mol-1。
②加入N2作为稀释剂,使体系的体积增大,相当于压强减小,有利于向正反应方向移动,C2H4的产率增大。
(3)①温度高于400℃时,温度升高,反应iv:2C3H6(g)![]() 3C2H4(g)ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小;当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大。
3C2H4(g)ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小;当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大。
②分压=总压×物质的量分数,因此400℃时,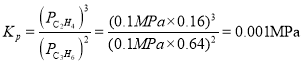
③结合图像,温度升高可以提高C2H4的物质的量分数,B正确;对于i、ii和iii来说,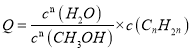 ,当n值越大,增大水醇比时,反应逆向进行趋势越大,副产物越少,即C3H6、C4H8就越少,A正确。
,当n值越大,增大水醇比时,反应逆向进行趋势越大,副产物越少,即C3H6、C4H8就越少,A正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
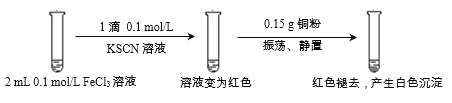
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
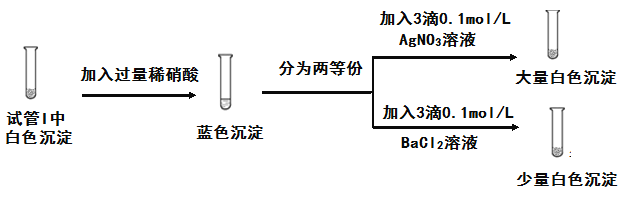
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
I | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 | |
II | 取I中上层清液于试管中,滴加1滴 0.1mol/L KSCN溶液 | 立刻出现红色,同时有白色沉淀生成 |
III | 振荡II中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。