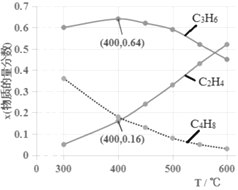
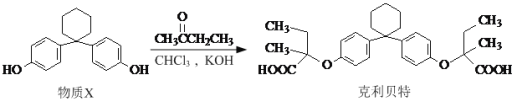题目内容
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
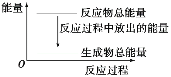
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
【答案】B
【解析】
A.放热反应Zn+H2SO4═ZnSO4+H2↑,则放热反应中反应物的总能量大于生成物的总能量,故A正确;
B.加入少许CuSO4溶液,Zn置换出Cu,形成ZnCu硫酸原电池,使Zn与稀硫酸的反应速率加快,故B错误;
C.Zn+H2SO4═ZnSO4+H2↑的反应中锌失去电子,化合价升高,作原电池的负极,故C正确;
D.在Zn+H2SO4=ZnSO4+H2↑反应中每转移2mol电子参加反应的Zn为1mol,现转移4mol电子,参加反应的Zn为2mol,则反应释放出2QkJ热量,故D正确;
答案选B。

【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇
匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象为_______________________________________________。
⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数_____(填“偏高”、“偏低”或“无影响”)。
⑵滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
1 | 25.OO | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.2 | 25.02 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?_____(写出解题过程)