题目内容
【题目】在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线________(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)3 min内,以X的浓度变化表示的平均反应速率为_____________。
(3)下列措施能使该反应速率加快的是________(用序号回答)。
①升高温度 ②减小容器体积 ③通入N2O4 ④通入Ar使压强增大 ⑤通入HCl气体
(4)下列叙述能说明该反应已达到化学平衡状态的是____________(填标号)。
A.容器内压强不再发生变化
B.混合气体的密度不变
C.容器内混合气体原子总数不变
D.混合气体的平均相对分子质量不变
E.v(NO2)=2v(N2O4)
F.相同时间内消耗n mol的Y的同时消耗2n mol的X
【答案】Y 0.1 mol/(Lmin) ①②③ A、D、F
【解析】
(1)根据相同时间内物质改变的物质的量的比等于化学计量数的比分析判断;
(2)根据v=![]() 计算反应速率;
计算反应速率;
(3)根据化学反应速率的影响因素分析判断;
(4)根据平衡是各种物质的浓度不变、物质的含量不变,反应速率不变分析判断。
(1)根据图示可知:在3 min内X改变的物质的量是0.6 mol,Y改变的物质的量是0.3 mol,n(X):n(Y)=0.6 mol:0.3 mol=2:1,所以X表示NO2,Y表示N2O4;
(2)反应在体积为2 L的密闭容器中进行,在3 min内NO2的物质的量变化了0.6 mol,所以用NO2表示的反应速率v(NO2)= =0.1 mol/(Lmin);
=0.1 mol/(Lmin);
(3)①升高温度,物质的内能增加,更多的分子变为活化分子,活化分子数增加,反应速率加快,①符合题意;
②减小容器体积,使物质的浓度增大,单位体积内活化分子数增加,反应速率加快,②符合题意;
③通入N2O4气体,使物质浓度增大,单位体积内活化分子数增加,反应速率加快,③符合题意;
④通入Ar使压强增大,但不能改变体系内的任何一种物质的浓度,化学反应速率不变,④不符合题意;
⑤通入HCl气体,与反应体系无关,不能改变物质的浓度,反应速率不变,⑤不符合题意;
故合理选项是①②③;
(4) A.该反应在恒容密闭容器中进行,反应前后气体的物质的量发生变化,若容器内压强不再发生变化,说明气体的物质的量不变,反应达到平衡状态,A正确;
B.容器的容积不变,反应混合物都是气体,气体的质量不变,则任何条件下气体的密度都不变,因此不能据此判断反应是否处于平衡状态,B错误;
C.反应混合物都是气体,反应遵循质量守恒定律,气体的质量不变,气体原子数目不变,所以不能据此判断反应是否处于平衡状态,C错误;
D.混合气体的总质量不变,若反应达到平衡状态,则气体的物质的量不变,单位物质的量的气体的质量也不变,气体平均相对分子质量不变,因此可据此判断反应处于平衡状态,D正确;
E.v(NO2)=2v(N2O4)未指明反应速率是正反应速率还是 逆反应速率,因此不能判断平衡状态,E错误;
F.相同时间内消耗n mol的Y就会产生2 n mol的X,同时消耗2n mol的X,则X的物质的量不变,由于容器的容积不变,则反应处于平衡状态,F正确;
故合理选项是A、D、F。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
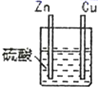
口算心算速算应用题系列答案【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
| 铜棒表面的现象是:有气体生成,电流计指针发生偏转 |
①通过实验2和3,可得出原电池的形成条件是______________;
②通过实验1和3,可得出原电池的形成条件是_______________;
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是_______;
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________;Cu棒:____________。
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇
匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象为_______________________________________________。
⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数_____(填“偏高”、“偏低”或“无影响”)。
⑵滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
1 | 25.OO | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.2 | 25.02 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?_____(写出解题过程)