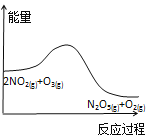
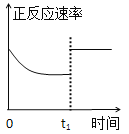
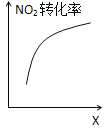题目内容
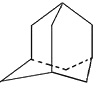
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
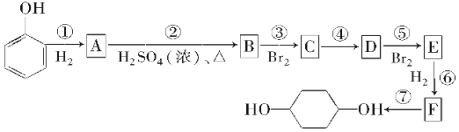
请回答下列问题:
(1)写出E的结构简式:___,B中有可能所有碳原子共面___(填是或否)。
(2)反应①~⑦中属于消去反应的是___,属于取代反应的是___。
(3)试写出A→B反应的化学方程式:___,C→D反应的化学方程式:___。
【答案】![]() 否 ②④ ⑦
否 ②④ ⑦ ![]()
![]()
![]() +H2O
+H2O ![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O
+2NaBr+2H2O
【解析】
与氢气发生加成反应生成A,A为![]() ,A在浓硫酸、加热条件下发生消去反应生成B,则B为
,A在浓硫酸、加热条件下发生消去反应生成B,则B为![]() ,B与溴发生加成反应生成C,则C为
,B与溴发生加成反应生成C,则C为![]() ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为 ![]() ,D与溴发生1,4-加成生成E,E为
,D与溴发生1,4-加成生成E,E为![]() ,E与氢气发生加成反应生成F,F为
,E与氢气发生加成反应生成F,F为![]() ,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为
,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为![]() ,据此分析。
,据此分析。
与氢气发生加成反应生成A,A为![]() ,A在浓硫酸、加热条件下发生消去反应生成B,则B为
,A在浓硫酸、加热条件下发生消去反应生成B,则B为![]() ,B与溴发生加成反应生成C,则C为
,B与溴发生加成反应生成C,则C为![]() ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D为 ![]() ,D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,F为
,D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,F为![]() ,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为
,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G为![]() 。
。
(1)E的结构简式为![]() ,B为
,B为![]() ,根据烯烃及环烷的结构可知,不可能所有碳原子共面;
,根据烯烃及环烷的结构可知,不可能所有碳原子共面;
(2)反应①③⑤⑥属于加成反应,反应②④属于消去反应,反应⑦属于取代反应,反应⑧属于缩聚反应,故答案为:②④;⑦;
(3)A→B为![]() 在浓硫酸、加热条件下发生消去反应生成
在浓硫酸、加热条件下发生消去反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]()
![]()
![]() +H2O;
+H2O;
C→D是![]() 在氢氧化钠醇溶液、加热条件下发生消去反应生成
在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() 、溴化钠和水,反应的化学方程式为
、溴化钠和水,反应的化学方程式为![]() +2NaOH
+2NaOH![]()
![]() +2NaBr+2H2O。
+2NaBr+2H2O。

 口算题天天练系列答案
口算题天天练系列答案【题目】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
N≡N | O=O | N-N | N-H | O-H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
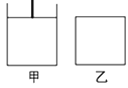
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A. 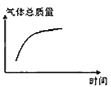 B.
B.  C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。