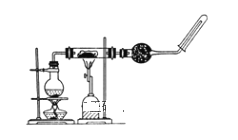
题目内容
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是__(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:___;C、N、O的第一电离能由大到小的顺序为__(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是___。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,1mol[Cu(NH3)2]+中含有σ键的数目___。则其中碳原子的杂化轨道类型是__,NH3分子的价电子对互斥理论模型是___。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
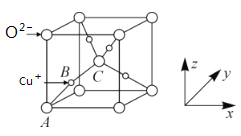
①若坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C的坐标参数为__;
),则C的坐标参数为__;
②若阿伏加德罗常数为NA,该晶胞的边长为apm,则晶体的密度为___gcm-3。
【答案】a N≡N N>O>C H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高 8NA sp3、sp2 四面体形 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)根据基态原子核外电子排布进行判断,基态排布为能量最低的排布;
(2)等电子体为原子总数相同,价电子总数也相同的微粒;
(3)沸点与范德华力和氢键的有关;
(4)根据结构和价电子互斥理论进行计算;
(5)根据晶胞结构和晶体密度方程回答问题。
(1)基态N的核外电子排布式为1s22s22p3,基态排布为能量最低的排布,电子排布图表示的状态中只有a项符合;
(2)等电子体为原子总数相同,价电子总数也相同的微粒,与CO互为等电子体的一种分子为N2,其结构式为:N≡N;同周期主族元素,随着原子序数增大,第一电离能呈增大的趋势,但第ⅤA族元素其价电子排布为ns2np3,其np中电子排布为半满结构,较稳定,因此其第一电离能比相邻元素大,所以C、N、O的第一电离能由大到小的顺序为:N>O>C;
(3)H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,但由于氢键的作用力比范德华力强,氢键会使沸点异常升高,会导致H2O的沸点异常的高,所以沸点大小为H2O>H2Te>H2Se>H2S,故答案为:H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高;
(4)铜显+1价,1mol[Cu(NH3)2]+中N-H键和配位键属于σ键,即含有σ键的数目8NA,甲基中碳原子形成4个σ键,没有孤电子对,杂化轨道数目为4,碳原子杂化方式为sp3,而羰基中C原子形成3个σ键,没有孤电子对,杂化轨道数目为3,碳原子杂化方式为sp2;NH3中N原子形成3个N-H键,含有1对孤对电子,价层电子对数=3+1=4,价电子对互斥理论模型是四面体形,故答案为:sp3、sp2;四面体形;
(5)①根据晶胞结构分析,C位于晶胞体心,则C的原子坐标为:(![]() );
);
②1mol晶胞,即有NA个晶胞,质量为m=2×(64×2+16)g=144×2g,所以密度为ρ=![]() 。
。

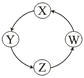
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④
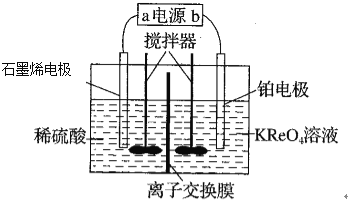
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。