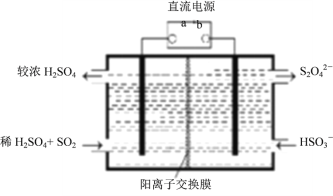
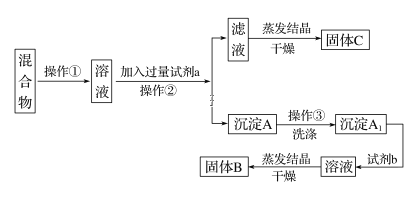
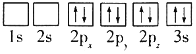
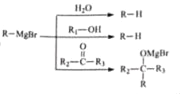
题目内容
【题目】室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
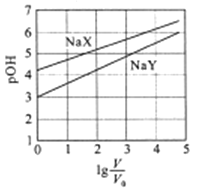
A. HX、HY都是弱酸,且Ka(HX)>Ka(HY)
B. 图中pOH随![]() 变化始终满足直线关系
变化始终满足直线关系
C. ![]() =3时,NaX溶液中所含离子总数小于NaY溶液
=3时,NaX溶液中所含离子总数小于NaY溶液
D. 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
【答案】A
【解析】A. NaX、NaY溶液pOH≠7,表明NaX、NaY发生水解,所以 HX、HY都是弱酸,浓度均为0.1mol/L.的NaX、NaY溶液的pH分别为4和3,表明水解程度:NaX<NaY,所以Ka(HX)>Ka(HY),故A正确;B. 当![]() 很大时,图中pOH变化很小,所以图中pOH随
很大时,图中pOH变化很小,所以图中pOH随![]() 变化不会始终满足直线关系,故B错误;C.溶液中电荷守恒:c(X-)+c(OH-)= c(Na+)+c(H+),c(OH-)+c(Y-)= c(Na+)+c(H+),
变化不会始终满足直线关系,故B错误;C.溶液中电荷守恒:c(X-)+c(OH-)= c(Na+)+c(H+),c(OH-)+c(Y-)= c(Na+)+c(H+), ![]() =3时,NaX溶液中pOH较大, c(OH-)较小,c(H+)较大,所含离子总数大于NaY溶液,故C错误;D. 分别向稀释前的两种溶液加盐酸至pH=7时,溶液中电荷守恒:c(X-)+c(OH-)+c(Cl-)= c(Na+)+c(H+),c(OH-)+c(Y-)+c(Cl-)= c(Na+)+c(H+),将c(OH-)= c(H+)代入得,c(X-)+c(Cl-)= c(Na+),c(Y-)+c(Cl-)= c(Na+),由于NaX溶液中pOH较大,加入盐酸较少,c(Cl-)较小,所以c(X-)>c(Y-),故D错误。故选A。
=3时,NaX溶液中pOH较大, c(OH-)较小,c(H+)较大,所含离子总数大于NaY溶液,故C错误;D. 分别向稀释前的两种溶液加盐酸至pH=7时,溶液中电荷守恒:c(X-)+c(OH-)+c(Cl-)= c(Na+)+c(H+),c(OH-)+c(Y-)+c(Cl-)= c(Na+)+c(H+),将c(OH-)= c(H+)代入得,c(X-)+c(Cl-)= c(Na+),c(Y-)+c(Cl-)= c(Na+),由于NaX溶液中pOH较大,加入盐酸较少,c(Cl-)较小,所以c(X-)>c(Y-),故D错误。故选A。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目