题目内容
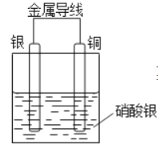
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确是( )
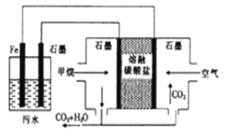
A. 铁电极的电极反应式为Fe-2e-=Fe2+
B. 通入甲烷的石墨的电极反应式为:CH4+4CO32-—8e- ==5CO2+2H2O
C. 为了增强的污水的导电能力,可向污水中加入适量食盐
D. 若左池石墨电极产生44.8L气体,则消耗0.5mol甲烷
【答案】D
【解析】
在甲烷燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32-—8e- =5CO2+2H2O,通入空气(氧气)的一极为原电池的正极,发生还原反应,电极方程式为O2+2CO2 +4e-=2CO32- ,铁连接原电池的正极,为电解池的阳极,被氧化,电极方程式为Fe-2e-=Fe2+ ,阴极电极方程式为2H + + 2e - =H2↑。
A.铁连接原电池的正极,为电解池的阳极,被氧化,电极反应为Fe-2e-=Fe2+ ,故不选A;
B.通甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32-—8e- =5CO2+2H2O,故不选B;
C.加入的使导电能力增强的电解质必须是可溶于水的、不参与电极反应的盐,可用食盐,故不选C;
D.未说明标准状况,无法计算,故选D;
答案:D

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍