题目内容
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[![]() ]和水碳比[
]和水碳比[![]() ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为____。
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由_____。
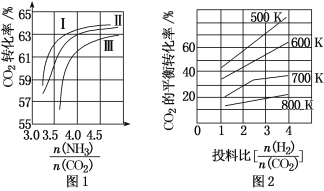
(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
①该反应的化学平衡常数的表达式为_____。
②该反应的ΔS___0,ΔH___0(填“>”或“<”)。
③700K投料比[![]() ]=2时,H2的平衡转化率为_____。
]=2时,H2的平衡转化率为_____。
【答案】0.6~0.7 4.0比较适宜;氨碳比在4.5时,NH3的量增大较多,而CO2转化率增加不大,提高了生产成本 K=![]() < < 45%
< < 45%
【解析】
(1)①依据反应转化率的大小分析,结合图象分析判断;
②氨碳比在4.5时氨气量增大对二氧化碳的转化率增加不大;
(2)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行书写;
②根据反应前后气体的物质的量大小判断△S,根据温度对平衡的影响分析△H;
③由图可知,在700K,投料比[n(H2):n(CO2)]=2时,二氧化碳转化率为 30%,假设CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为 0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2的转化率。
(1)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为0.6~0.7;
②氨碳比在4.5时,需要氨气较多,但依据图象分析二氧化碳转化率增大不多,工业 合成氨生成工艺较复杂,提高生产成本,所以氨碳比应该控制在4.0左右;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=![]() ;
;
②因为该反应为气体减小的反应,则△S<0,因为温度越高,CO2转化率越小,说明升高温度,平衡向逆反应方向移动,逆反应为吸热反应,则该反应正方向为放热反应,即△H<0;
③由图可知,在700K,投料比[n(H2):n(CO2)]=2时,二氧化碳转化率为 30%,假设CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为 0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2的转化率= 0.9mol 2mol ×100%=45%。

【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为________(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________mol·L-1。
(3)为减少SO2的排放,可用某些溶液洗涤含SO2的烟气。以下物质可做洗涤剂的是__________________________(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_____________________________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________。