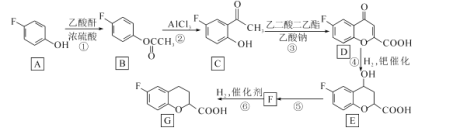
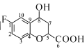
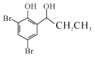
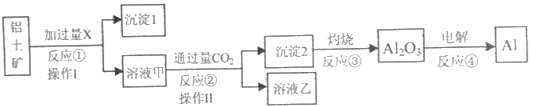
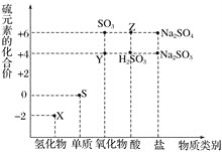
题目内容
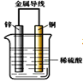
【题目】如图为Zn-Cu原电池的示意图,请回答:

(1)锌片为原电池的_____极,铜片为原电池的____极(填“正”或“负”)
(2)锌电极反应式是_______,属于______反应(填“氧化”或“还原”);铜电极反应式是______,属于______反应(同上)。
(3)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+在______(填“锌片”或“铜片”)获得电子。
(4)若锌片减轻0.1mol,则另一极放出气体的物质的量为_____mol。
【答案】负 正 Zn-2e-=Zn2+ 氧化 2H++2e-=H2↑ 还原 电子 铜片 0.1
【解析】
锌比铜活泼,为原电池的负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,铜为原电池的正极,发生还原反应,电极反应式为2H++2e-=H2↑,电池总反应为Zn+2H+=Zn2++H2↑,结合原电池原理分析解答。
(1)锌比铜活泼,为原电池的负极,铜片为原电池的正极,故答案为:负;正;
(2)锌比铜活泼,为原电池的负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,铜为原电池的正极,发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:Zn-2e-=Zn2+;氧化;2H++2e-=H2↑;还原;
(3)锌比铜活泼,为原电池的负极,锌失去电子,电子从锌片通过导线流向铜片,铜做正极,溶液中氢离子在铜片上得到电子生成氢气,发生还原反应,故答案为:电子;铜片;
(4)根据Zn-2e-=Zn2+,n(Zn)=0.1mol,转移电子0.2mol,根据2H++2e-=H2↑,转移0.2mol电子,生成氢气0.1mol,故答案为:0.1。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目