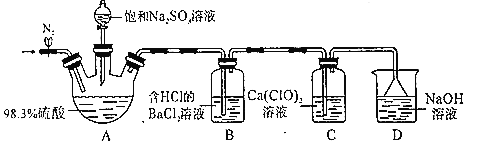
��Ŀ����
����Ŀ��ZrO2�������մɲ��ϣ������Ӣɰ(��Ҫ�ɷ�ΪZrSiO4����������FeCO3��Fe2O3��Al2O3��SiO2������)ͨ������������ȡ��

��֪����ZrSiO4�����ռӦ����Na2ZrO3��Na2SiO3��Na2ZrO3���ᷴӦ����ZrO2+
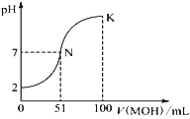
�ڲ��ֽ���������ʵ�������¿�ʼ��������ȫ������pH���±���

(1)�������������У� ZrSiO4������Ӧ�Ļ�ѧ����ʽ��______________________����I�Ļ�ѧʽΪ_______________
(2)�������������У�������Ӧ�����ӷ���ʽ��__________________����pH=a��ʱ��a�ķ�Χ��________________
(3)Ϊ�õ�������ZrO2��������Ҫ��ˮϴ����������Ƿ�ϴ�Ӹɾ��ķ�����________________
(4)������ijɷ���Zr(CO3)2��xZr(OH)4ȡ�ɲٺ�������� 37.0g�����պ�ɵõ�24.6 g ZrO2��x����____________________������pH=8.0��ʱ����������Ӧ�����ӷ���ʽΪ________ ��
���𰸡�ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O H2SiO3 2Fe2++H2O2+2H+=2Fe3++2H2O 5.2��a<6.2 ȡ���һ��ϴ��Һ���Թ��У����������ữ��AgNO3��Һ�����ް�ɫ��������˵����ϴ�ɾ� 1 2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4��
��������
�Ӣɰ����Ҫ�ɷ�ΪZrSiO4����������FeCO3��Fe2O3��Al2O3��SiO2�����ʣ�����NaOH���ڣ�ZrSiO4ת��ΪNa2SiO3��Na2ZrO3��������ת��ΪNaAlO2��SiO2ת��ΪNa2SiO3��Fe2O3����Ӧ���ټӹ������������Na2ZrO3���ᷴӦ����ZrO2+��Na2SiO3��HCl���ɹ��������ƫ������ת��Ϊ�Ȼ�����̼��������������ת��Ϊ�Ȼ��������Ȼ��������˷��룬����IΪ���ᣬ��Һ�к���ZrO2+��Fe2+��Fe3+��Al3+��Na+��Cl-�ȣ�����������������������ӣ��Ӱ�ˮ����pH��ʹFe3+��Al3+ת��Ϊ����������������˷�������IIΪ����������������������Һ����Ҫ����ZrO2+��NH4+��Cl-��Na+��Cl-�ȣ��ټӰ�ˮ����pH��ʹZrO2+ת��ΪZr��OH��4���������ˡ�ϴ�ӡ�����õ�Zr��OH��4�����ȷֽ⼴�ɵõ�ZrO2���Դ˽����⡣
��1���������Ϣ֪�� ZrSiO4��NaOH��Ӧ����Na2SiO3��Na2ZrO3���䷴Ӧ�ķ���ʽΪ��ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O���ӹ������������Na2SiO3��HCl���ɹ�����������ˣ�����IΪH2SiO3���ʴ�Ϊ��ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O��H2SiO3��
��2���������������У�˫��ˮ�����������½�Fe2+����ΪFe3+����Ӧ�����ӷ���ʽ��2Fe2++H2O2+2H+=2Fe3++2H2O������pH����ʹ�����Ӻ���������ȫ��������Ҫ��������Zr(OH)4���ɱ������ݿ�֪pH�ķ�ΧΪ5.26.2���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��5.2��a<6.2��
��3��Zr(OH)4����Ϊ����Cl-�ȣ�����Zr(OH)4�Ƿ�ϴ�Ӹɾ��ķ����ǣ�ȡ���һ��ϴ��Һ���Թ��У����������ữ��AgNO3��Һ�����ް�ɫ��������˵����ϴ�ɾ����ʴ�Ϊ��ȡ���һ��ϴ��Һ���Թ��У����������ữ��AgNO3��Һ�����ް�ɫ��������˵����ϴ�ɾ���
��4��������ijɷ���Zr(CO3)2xZr(OH)4��ȡ�ɲٺ��������37.0g�����պ�ɵõ�24.6gZrO2����![]() ��x=1������pH=8.0��ʱ����Ӧ����Zr(CO3)2��Zr(OH)4������������Ӧ�����ӷ���ʽΪ��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4�����ʴ�Ϊ1��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4����
��x=1������pH=8.0��ʱ����Ӧ����Zr(CO3)2��Zr(OH)4������������Ӧ�����ӷ���ʽΪ��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4�����ʴ�Ϊ1��2ZrO2++2CO32-+2H2O=Zr(CO3)2��Zr(OH)4����

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�����Ŀ���⼰��Ͻ���ұ�𡢵����ȷ����й㷺Ӧ�á���1L�����ܱ������г���������Na2CO3��MoS2��H2��������Ӧ��MoS2(s)+2Na2CO3(s)+4H2(g)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ��H������ڲ�ͬ�¶���H2�����ʵ�����ʱ���ϵ���������ʾ������˵��������ǣ� ��
min mol K | 0 | 10 | 20 | 30 | 40 |
T1 | 2 | 1.6 | 1.3 | 1.0 | 1.0 |
T2 | 2 | 1.2 | 1.0 | n | 0.6 |
A.T2��T1����H��0
B.������n=0.6
C.T2K��20minʱ��v����v��
D.T1K��ƽ�ⳣ��K=0.25��molL-1��2