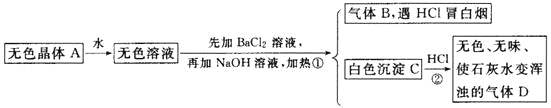
��Ŀ����
����Ŀ�������γɶ��ֵ��ʻ���ش��������⣺
(1)����(P4)��������ȼ�ղ���������ɫ����������PCl3��PCl5��
��P4��ѧ���ʱ�N2���õ���Ҫԭ����___________________________��
���γ�PCl5ʱ��Pԭ�ӵ�һ��3s���Ӽ�����3d��������ɼ���д���ü���̬ԭ�ӵ���Χ���ӹ����ʾʽ___________________________________��
��PCl5��һ�ְ�ɫ���壬��ѹ����148��Һ�����γ����ӵ��壬����������Ϊ��������ṹ��������Ϊ��������ṹ�������ӵ����ܵ����ԭ����_______(�õ��뷽��ʽ����)��
(2)���Ͱ뵼����� ���ף���һ�ֶ�ά����(�ṹ����ͼ����ʾ)���䵥��Ľṹ����ͼ����ʾ��
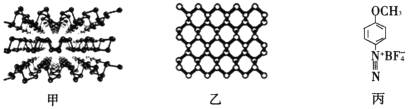
�ٺ�����Pԭ�ӵ��ӻ���ʽΪ_____________________________��
����4���������ص����ķ�������(����ͼ����ʾ)�����������ײ��ϣ����Ա����Ϳ��������ʡ����εĹ���Ԫ����N��O��F�ĵ縺���ɴ�С˳��Ϊ__________________��1mol���ε������Ӻ��е���������ĿΪ____________(�����ӵ�������ֵ��NA��ʾ����ͬ)��
(3)�й���ѧԺ�����Ƚ������о�Ժ�ڸ��ѿ�/���������ϲ��ϵ��о�����ȡ���½�չ���ò��ϱ��ֳ�����Ĺ��Ӧ��DZ������ͼ��ʾΪ���³����������һ�ֻ����� ���ѿ��ṹ����ͼ��������߳�Ϊa nm����þ�����ܶ�Ϊ____________g��cm��3��
���𰸡�P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ� ![]() 2PCl5��
2PCl5��![]() +
+![]() sp3 F��O��N 17NA
sp3 F��O��N 17NA ![]()
��������
����P4��N2�Ľṹ���ӹ��ۼ��ļ��ܴ�С�ó�P4��ѧ���ʱ�N2���õ���Ҫԭ����PCl5�У�Oԭ�ӵļ۵����Ų�ʽΪ3s23p3����Pԭ�ӵ�һ��3s���Ӽ�����3d����۵����Ų�ʽΪ3s13p33d1���ɴ�д���伤��̬ԭ�ӵ���Χ���ӹ����ʾʽ��PCl5��ѹ����148��Һ�����γ����ӵ��壬������������ṹ��������Ϊ![]() ����������ṹ��������Ϊ
����������ṹ��������Ϊ![]() ���ں����У�ÿ��Pԭ������Χ��4��Pԭ���γɹ��ۼ����ɴ˿ɵó�Pԭ�ӵ��ӻ���ʽ���Ƚ�N��O��F�ĵ縺��ʱ�����ȱȽϷǽ����ԣ��ǽ�����Խǿ���縺��Խ���ε��������У��ж��ٸ�ԭ�Ӽ��γɹ��ۼ����ͺ��ж��ٸ�������������ܶ�ʱ�������1�������������е�Ca��Ti��Oԭ�Ӹ������Ӷ����1�������������������1���������������ɵó�������ܶȡ�
���ں����У�ÿ��Pԭ������Χ��4��Pԭ���γɹ��ۼ����ɴ˿ɵó�Pԭ�ӵ��ӻ���ʽ���Ƚ�N��O��F�ĵ縺��ʱ�����ȱȽϷǽ����ԣ��ǽ�����Խǿ���縺��Խ���ε��������У��ж��ٸ�ԭ�Ӽ��γɹ��ۼ����ͺ��ж��ٸ�������������ܶ�ʱ�������1�������������е�Ca��Ti��Oԭ�Ӹ������Ӷ����1�������������������1���������������ɵó�������ܶȡ�
(1)��P4�ĽṹʽΪ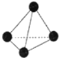 ��N2�ĽṹʽΪN��N����ѧ���ʱ�N2���õ���Ҫԭ����P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ�����Ϊ��P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ���
��N2�ĽṹʽΪN��N����ѧ���ʱ�N2���õ���Ҫԭ����P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ�����Ϊ��P4�����д���P-P��������N2�����д���N��N�������ܽϴ�ѧ���ʱȽ��ȶ���
���γ�PCl5ʱ��Pԭ�ӵ�һ��3s���Ӽ�����3d��������ɼ����۵����Ų�ʽΪ3s13p33d1���ü���̬ԭ�ӵ���Χ���ӹ����ʾʽΪ![]() ����Ϊ��
������![]() ��
��
��PCl5��һ�ְ�ɫ���壬��ѹ����148��Һ�����γ����ӵ��壬������������ṹ��������Ϊ![]() ����������ṹ��������Ϊ
����������ṹ��������Ϊ![]() ��Һ������������ƶ������������ӣ������ӵ����ܵ����ԭ����2PCl5��
��Һ������������ƶ������������ӣ������ӵ����ܵ����ԭ����2PCl5��![]() +
+![]() ������2PCl5��
������2PCl5��![]() +
+![]() ��
��
(2)���ں����У�ÿ��Pԭ������Χ��4��Pԭ���γɹ��ۼ���������Pԭ�ӵ��ӻ���ʽΪsp3����Ϊ��sp3��
�ڸ��εĹ���Ԫ���У�N��O��F�ķǽ�����F��O��N����縺���ɴ�С˳��ΪF��O��N�����ε�������Ϊ![]() ��1����������ԭ�Ӽ乲�γ�17�����۵�����˫����������ÿ2��ԭ�Ӽ�ֻ���γ�1������������1mol���������к��е���������ĿΪ17NA����Ϊ��F��O��N��17NA��
��1����������ԭ�Ӽ乲�γ�17�����۵�����˫����������ÿ2��ԭ�Ӽ�ֻ���γ�1������������1mol���������к��е���������ĿΪ17NA����Ϊ��F��O��N��17NA��
(3)��ͼ�У�1�������й�����Ca�ĸ���Ϊ1����Ti�ĸ���Ϊ8��![]() =1����O�ĸ���Ϊ12��
=1����O�ĸ���Ϊ12��![]() =3��������߳�Ϊa nm����þ�����ܶ�Ϊ
=3��������߳�Ϊa nm����þ�����ܶ�Ϊ![]() =
=![]() g��cm��3������
g��cm��3������![]() ��
��