题目内容
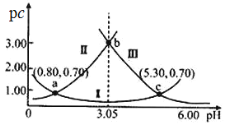
【题目】常温下,某浓度的H2A溶液中滴加NaOH溶液,若定义pc=-lgc,则测得pc(H2A)、pc(HA-)、pc(A2-)变化如图所示。下列说法错误的是( )
A.pH=3时溶液中c(A2-)>c(H2A)>c(HA-)
B.常温下,H2A的Ka1=10-0.80,Ka2=10-5.30
C.NaHA溶液中c(H+)>c(OH-)
D.从a点到c点,![]() 先增大后减小
先增大后减小
【答案】AD
【解析】
pc=-lgc,则浓度越大,pc越小,溶液中存在H2A分子,说明H2A为二元弱酸,其电离方程式为:H2AH++HA-,HA-H++A2-,pH增加促进电离平衡正向移动,所以由图可知:Ⅰ曲线是HA-的物质的量浓度的负对数,Ⅱ曲线是H2A的物质的量浓度的负对数,Ⅲ曲线是A2-的物质的量浓度的负对数,以此解答该题。
A.由图象可知,pH=3时溶液中pc(A2-)>pc(H2A)>pc(HA-),pc=-lgc,则浓度越大,pc越小,故离子的浓度大小关系为:c(HA-)>c(H2A)>c(A2-),故A错误;
B.H2A为二元弱酸,其电离方程式为:H2AH++HA-,HA-H++A2-,Ka1=![]() ,Ka2=
,Ka2=![]() ,图象上的a点可知,当pH=0.80时,pc(H2A)= pc(HA-)=0.70,c(H+)= 10-0.80,c(H2A)=c(HA-)=10-0.70,Ka1=10-0.80,由c点可知,当pH=5.30时,pc(A2-)= pc(HA-)=0.70,c(H+)= 10-5.30,c(A2-)=c(HA-)=10-0.70,Ka2=10-5.30,故B正确;
,图象上的a点可知,当pH=0.80时,pc(H2A)= pc(HA-)=0.70,c(H+)= 10-0.80,c(H2A)=c(HA-)=10-0.70,Ka1=10-0.80,由c点可知,当pH=5.30时,pc(A2-)= pc(HA-)=0.70,c(H+)= 10-5.30,c(A2-)=c(HA-)=10-0.70,Ka2=10-5.30,故B正确;
C.根据电离平衡可知,HA-H++A2-,Ka2=![]() =10-5.30,根据水解平衡可知,HA-+H2O=H2A+OH-,Kh=
=10-5.30,根据水解平衡可知,HA-+H2O=H2A+OH-,Kh=![]() ,Ka2>Kh,溶液显酸性,c(H+)>c(OH-),故C正确;
,Ka2>Kh,溶液显酸性,c(H+)>c(OH-),故C正确;
D.从a点到c点,Ka1=![]() ,c(HA-)先增大,后减小,由于温度不变,Ka1不变,则
,c(HA-)先增大,后减小,由于温度不变,Ka1不变,则![]() 先减小后增大,故D错误;
先减小后增大,故D错误;
答案选AD。

 中考解读考点精练系列答案
中考解读考点精练系列答案