题目内容
【题目】硼化镁是迄今发现的临界温度最高的简单的金属化合物超导材料。回答下列问题:
(1)基态硼的电子排布图为__,基态镁原子的电子运动状态有__种。
(2)BF3的键角(填“大于”、“小于”或“等于”)__NF3的键角,理由是__。
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是__。
(4)已知硼化镁属六方晶系(如图1所示)a=b≠c,α=β=90°,γ=120°。又知硼化镁是一种插层型离子化合物,镁层和硼层交替排列;镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,与石墨相似。硼化镁晶体沿z轴方向的投影如图2所示,黑球代表硼原子,白球代表镁原子。硼化镁的化学式为__;B的配位数是__。

(5)已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,则硼化镁晶体的密度表达式为__g/cm3(用NA表示阿伏加德罗常数)。
【答案】![]() 12 大于 BF3空间构型是平面正三角形,键角120°,NF3空间构型是三角锥形,键角小于109°28′(或BF3中B原子采用sp2杂化,无孤对电子,键角为120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′) 镁离子、钙离子的电荷数相同,镁离子的半径小,夺取碳酸根离子中的氧离子的能力强,所以碳酸镁的热分解温度低。(或MgO的晶格能大于CaO的晶格能,所以MgCO3比CaCO3更容易分解) MgB2 6
12 大于 BF3空间构型是平面正三角形,键角120°,NF3空间构型是三角锥形,键角小于109°28′(或BF3中B原子采用sp2杂化,无孤对电子,键角为120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′) 镁离子、钙离子的电荷数相同,镁离子的半径小,夺取碳酸根离子中的氧离子的能力强,所以碳酸镁的热分解温度低。(或MgO的晶格能大于CaO的晶格能,所以MgCO3比CaCO3更容易分解) MgB2 6 
【解析】
(1)硼为5号元素,基态硼的电子排布图为![]() ,镁核外有12个电子,基态镁原子的电子运动状态有12种。故答案为:
,镁核外有12个电子,基态镁原子的电子运动状态有12种。故答案为:![]() ;12;
;12;
(2)BF3的键角大于NF3的键角,理由是BF3空间构型是平面正三角形,键角120°,NF3空间构型是三角锥形,键角小于109°28′(或BF3中B原子采用sp2杂化,无孤对电子,键角为120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′)。故答案为:大于;BF3空间构型是平面正三角形,键角120°,NF3空间构型是三角锥形,键角小于109°28′(或BF3中B原子采用sp2杂化,无孤对电子,键角为120°;NF3中N原子采用sp3杂化,有一对孤对电子,键角小于109°28′);
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是镁离子、钙离子的电荷数相同,镁离子的半径小,夺取碳酸根离子中的氧离子的能力强,所以碳酸镁的热分解温度低。(或MgO的晶格能大于CaO的晶格能,所以MgCO3比CaCO3更容易分解)。故答案为:镁离子、钙离子的电荷数相同,镁离子的半径小,夺取碳酸根离子中的氧离子的能力强,所以碳酸镁的热分解温度低。(或MgO的晶格能大于CaO的晶格能,所以MgCO3比CaCO3更容易分解);
(4)由均摊法,观察图1,晶胞中B:6;Mg:12×![]() +2×
+2×![]() =3,硼化镁的化学式为MgB2;由于硼化镁是一种插层型离子化合物,镁层和硼层交替排列,镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,所以,每个B原子所在层的上下两层分别有3个Mg原子与B相邻,故B的配位数是6。故答案为:MgB2;6;
=3,硼化镁的化学式为MgB2;由于硼化镁是一种插层型离子化合物,镁层和硼层交替排列,镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,所以,每个B原子所在层的上下两层分别有3个Mg原子与B相邻,故B的配位数是6。故答案为:MgB2;6;
(5) 已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,晶胞质量:![]() 晶胞体积:
晶胞体积:![]() nm3,则硼化镁晶体的密度表达式为
nm3,则硼化镁晶体的密度表达式为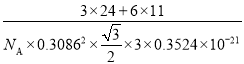 g/cm3(用NA表示阿伏加德罗常数)。故答案为:
g/cm3(用NA表示阿伏加德罗常数)。故答案为: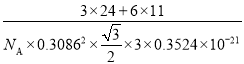 。
。

【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na