题目内容
【题目】根据化学原理的相关知识填空。
⑴常温时,![]() 的水溶液呈酸性,原因是
的水溶液呈酸性,原因是![]() 用离子方程式表示
用离子方程式表示![]() :___________,将
:___________,将![]() 溶液蒸干,灼烧,最后得到的固体产物主要是__________
溶液蒸干,灼烧,最后得到的固体产物主要是__________![]() 填化学式
填化学式![]() 。
。
⑵向![]() 溶液滴加石蕊溶液后变红,则
溶液滴加石蕊溶液后变红,则![]() 的电离程度______其水解程度
的电离程度______其水解程度![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。该物质能_______
。该物质能_______![]() 填“促进”或“抑制”
填“促进”或“抑制”![]() 水的电离。
水的电离。
⑶若想除去![]() 溶液中混有
溶液中混有![]() 杂质,则往往加入试剂 ________。
杂质,则往往加入试剂 ________。
![]()
![]()
![]()
![]()
⑷泡沫灭火器的灭火原理为___________![]() 用离子方程式解释
用离子方程式解释![]()
⑸在苏打溶液中存在的电荷守恒式为__________;质子守恒式为__________
⑹常温下,物质的量浓度相同的下列溶液:![]()
![]()
![]()
![]()
![]() 溶液中
溶液中![]() 从大到小排列顺序为________
从大到小排列顺序为________![]() 填序号
填序号![]() 。
。
⑺现有a.醋酸、b.盐酸、c.硫酸三种溶液,根据要求答题。
![]() 若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
若它们物质的量浓度相等,它们的pH由大到小的关系为_______(用abc表示,下同)。
![]() 若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
若它们的pH相等,它们物质的量浓度由大到小的关系为_____。
![]() 若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
若它们的pH相等,均加水稀释100倍后,其pH由大到小的关系为________。
【答案】![]()
![]()
![]() 抑制
抑制 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
⑴常温时,![]() 的水溶液水解显酸性,HCl易挥发,因此
的水溶液水解显酸性,HCl易挥发,因此![]() 溶液蒸干,灼烧,得到最后的固体产物。
溶液蒸干,灼烧,得到最后的固体产物。
⑵向![]() 溶液滴加石蕊溶液后变红,显酸性。
溶液滴加石蕊溶液后变红,显酸性。
⑶若想除去![]() 溶液中混有
溶液中混有![]() 杂质,利用铁离子水解,加对应的被提纯物质的难溶于水的氧化物或碳酸物。
杂质,利用铁离子水解,加对应的被提纯物质的难溶于水的氧化物或碳酸物。
⑷泡沫灭火器的灭火原理硫酸铝和碳酸氢钠反应。
⑸根据苏打溶液中存在的电荷守恒式,质子守恒式写出。
⑹常温下,物质的量浓度相同的各种溶液中铵根离子水解与其它离子之间的关联。
⑺利用醋酸部分电离,盐酸、硫酸全部电离思想以及一元强酸和一元弱酸的比较来解题。
⑴![]() 为强酸弱碱盐,
为强酸弱碱盐,![]() 水解溶液呈酸性,离子方程式为:
水解溶液呈酸性,离子方程式为:![]() ;
;![]() 溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝(Al2O3);故答案为:
溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝(Al2O3);故答案为:![]() ;
;![]() 。
。
⑵向![]() 溶液滴加石蕊溶液后变红则溶液显酸性,则
溶液滴加石蕊溶液后变红则溶液显酸性,则![]() 的电离程度大于其水解程度;
的电离程度大于其水解程度;![]() 电离的氢离子抑制水的电离;故答案为:
电离的氢离子抑制水的电离;故答案为:![]() ;抑制。
;抑制。
⑶![]() 会与
会与![]() 反应不可用;
反应不可用;![]() 会与
会与![]() 反应不可用;
反应不可用;![]() 发生水解
发生水解![]() ,CuO消耗水解生成的
,CuO消耗水解生成的![]() ,使平衡正向移动,可促进水解又不引入新的杂质,过量也可以一起过滤除去,故可除杂;
,使平衡正向移动,可促进水解又不引入新的杂质,过量也可以一起过滤除去,故可除杂;![]() 发生水解
发生水解![]() ,
,![]() 消耗水解生成的
消耗水解生成的![]() ,使平衡正向移动,可促进水解又不引入新的杂质,过量也可以一起过滤除去,故可除杂;故答案为:
,使平衡正向移动,可促进水解又不引入新的杂质,过量也可以一起过滤除去,故可除杂;故答案为:![]() 。
。
⑷泡沫灭火器的灭火原理为硫酸铝和碳酸氢钠反应生成氢氧化铝沉淀、硫酸钠和二氧化碳,离子方程式为:![]() ;故答案为:
;故答案为:![]() 。
。
⑸苏打溶液含有的阳离子有钠离子、氢离子,阴离子有氢氧根离子、碳酸根离子和碳酸氢根离子,故含有电荷守恒![]() ;水中电离出
;水中电离出![]() 等于水电离出的
等于水电离出的![]() ,溶液中
,溶液中![]() 中的H和
中的H和![]() 中的H均来自水电离的
中的H均来自水电离的![]() ,故苏打溶液中质子守恒式为
,故苏打溶液中质子守恒式为![]() ;故答案为:
;故答案为:![]() ;
;![]() 。
。
⑹![]() 和
和![]() 的铵离子浓度大,
的铵离子浓度大,![]() 溶液中的
溶液中的![]() 会减弱
会减弱![]() 的水解,故
的水解,故![]() 溶液中
溶液中![]() 大于
大于![]() ;
;![]() 中电离出的
中电离出的![]() 会抑制
会抑制![]() 的水解,故
的水解,故![]() 溶液中
溶液中![]() 大于
大于![]() 和
和![]() ;
;![]() 中
中![]() 溶液中
溶液中![]() 与
与![]() 发生双水解,故
发生双水解,故![]() 溶液中
溶液中![]() 小于
小于![]() ;故答案为:
;故答案为:![]() 。
。
⑺![]() 盐酸、硫酸都为强酸,相同物质的量浓度下,为二元强酸的硫酸
盐酸、硫酸都为强酸,相同物质的量浓度下,为二元强酸的硫酸![]() 电离的
电离的![]() 比盐酸
比盐酸![]() 电离的
电离的![]() 多,醋酸为一元弱酸,电离的
多,醋酸为一元弱酸,电离的![]() 最少,故
最少,故![]() 的由大到小是cba,而
的由大到小是cba,而![]() 越多,pH越小,故pH由大到小为abc;
越多,pH越小,故pH由大到小为abc;![]() 若它们的pH相等,即电离的
若它们的pH相等,即电离的![]() 相等,与
相等,与![]() 中逆推,可知它们物质的量浓度由大到小为abc;
中逆推,可知它们物质的量浓度由大到小为abc;![]() 若它们的pH相等,强酸的
若它们的pH相等,强酸的![]() 全部电离,稀释同等倍数的pH增长相同,但弱酸越稀,越促进其电离,故醋酸的pH增大值没有强酸快,故pH由大到小的关系为
全部电离,稀释同等倍数的pH增长相同,但弱酸越稀,越促进其电离,故醋酸的pH增大值没有强酸快,故pH由大到小的关系为![]() ;故答案为:abc;abc;
;故答案为:abc;abc;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
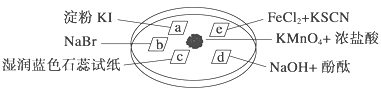
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D