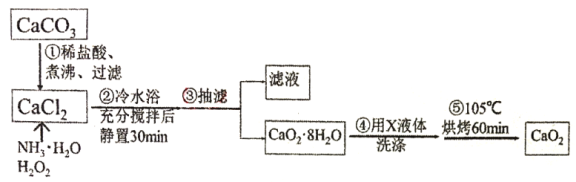
题目内容
【题目】在2 L和密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g),反应进行到5min时,测得N2O5转化了20%,求:
4NO2(g)+O2(g),反应进行到5min时,测得N2O5转化了20%,求:
(1)5min时,剩余N2O5的物质的量________;
(2)前5min,v(NO2)为多少__________;
(3)5min时,O2的物质的量占混合气体总物质的量的百分比_________。
【答案】3.2mol 0.16mol/(L·min) 7.69%
【解析】
(1)根据转化率计算剩余的N2O5的物质的量;
(2)根据N2O5的转化量,计算出v(N2O5),然后利用不同物质表示的速率关系计算v(NO2);
(3)计算出5min时各种气体的物质的量,然后根据体积分数的定义计算。
(1)转化的N2O5的物质的量=4mol×20%=0.8mol,故剩余N2O5的物质的量n(N2O5)=4mol-0.8mol=3.2mol;
(2)在前5min内转化的N2O5的物质的量=4mol×20%=0.8mol,则v(N2O5)=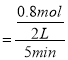 =0.08mol/(L·min)。根据方程式2N2O5(g)
=0.08mol/(L·min)。根据方程式2N2O5(g)![]() 4NO2(g)+O2(g)中物质反应转化关系可知v(NO2)=2v(N2O5)=2×0.08mol/(L·min)= 0.16mol/(L·min);
4NO2(g)+O2(g)中物质反应转化关系可知v(NO2)=2v(N2O5)=2×0.08mol/(L·min)= 0.16mol/(L·min);
(3)根据(1)可知5min时,N2O5反应消耗了0.8mol,则根据方程式中物质转化关系可知会产生0.16molNO2、0.4molO2,所以5min时混合气体的总物质的量n=n(N2O5)+n(NO2)+n(O2)=3.2mol+1.6mol+0.4mol=5.2mol,则O2占混合气体总物质的量的百分比为![]() ×100%=7.69%。
×100%=7.69%。

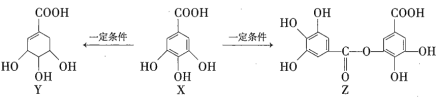
【题目】黄钾铁矾渣经如下流程可将其转化为锰锌铁氧体:

已知:①黄钾铁矾渣中铁主要以Fe2O3形式存在,锌主要以硫酸锌(ZnSO4)、氧化锌(ZnO)、硅酸锌(ZnSiO3)形式存在,黄钾铁矾渣的某些元素成分如下表所示:
元素 | Fe | Zn | Cu | Cd | Ca | Mg | Si |
质量分数 | 28.9 | 8.77 | 0.37 | 0.18 | 0.37 | 0.84 | 4.63 |
②NH4F溶液用于沉淀Mg2+和Ca2+,②Fe和Cd的金属活动性相近
⑴“酸浸”后,滤渣1的主要成分为________(写化学式);为了提高浸出率,可采取的措施有________(写出一种即可)。
⑵“还原除杂”工序中,加入铁粉是为了除去溶液中________、________等金属杂质离子。
⑶加入(NH4)2S沉淀Cd2+时应避免过量,原因是________;若此过程中溶液搅拌时间过长,则会导致Cd2+去除率偏低,原因是________。(已知:CdS的溶度积Ksp = 8×10-27,FeS的溶度积Ksp = 4×10-19,ZnS的溶度积Ksp = 1.6×10-24)
⑷写出“共沉淀”工序中生成FeCO3的离子反应方程式为:________。
⑸锰锌铁氧体是一种重要的磁性材料。测定铁氧体中ZnO的实验步骤如下:

①写出除锰(Mn2+)步骤中的离子方程式________。
②准确量取25.00 mL溶液A,掩蔽铁后,用二甲酚橙作指示剂,用0.0100mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+ (反应原理为Zn2+ + H2Y2- =ZnY 2- + 2H+),至滴定终点时消耗EDTA标准溶液20.00 mL。通过计算确定该铁氧体中ZnO的质量分数为________。
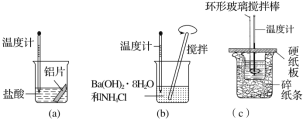
【题目】某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚兴趣,试通过实验来探究其成分。
Ⅰ、实验装置:

该装置B中发生的离子方程式是 ______,装置B的作用是 ______。
Ⅱ、实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ、实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,他增加一个实验:用磁铁靠近黑色固体,看到有黑色固体被磁铁吸引,于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们的结论作出判断,并通过实验检验其合理性:
⑴在一定条件下,一氧化碳与氧化铁在加热条件下,可发生如下反应:
CO +3Fe2O3 = 2Fe3O4+ CO2↑ 4CO + Fe3O4 = Fe+ 4CO2↑
⑵四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论 ______。你对此评价的理由是 ______。
Ⅳ、实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中 ______ 。
为确定实验中最后产物中的成分,丙同学设计如下实验,请你利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器:1mol/L CuSO4、0.01mol/L KSCN溶液、1mol/L 盐酸、0.01mol/L 氨水、试管、玻璃棒、胶头滴管。
实验操作 | 预期现象和结论 |
步骤一;取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/L CuSO4溶液,搅拌溶解。 | ⑴若A试管中黑色固体不溶解,并且没有观察到其它现象,则黑色固体为 ______。 ⑵若B试管中有红色固体析出,则说明黑色固体中含有 ______。 |
步骤二:对试管B中溶液过滤,将所得固体洗涤干净后加足量1mol/L盐酸后再依次分别加入适量0.01mol/L氨水、少量0.01mol/L KSCN溶液。 | ①若溶液不变红色,则______。 ②若溶液变红色,则______。 |
Ⅴ、延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)______(填“行”或“不行”),理由是:______。