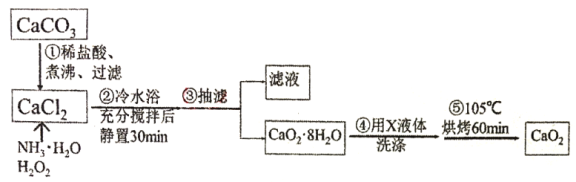
题目内容
【题目】(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是____________________________。
(3)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:
A________;B________;C________;D________。
(4)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A________;B________;C________;D________。

【答案】离子键 共价键 分子间作用力 CO2 H2 H2、CO2、HF HF (NH4)2SO4 SiC SiC>(NH4)2SO4>HF>CO2>H2 金属晶体 分子晶体 离子晶体 原子晶体 氯化铯 氯化钠 二氧化硅 金刚石
【解析】
(1)氯酸钾是离子晶体,熔化时破坏离子键;二氧化硅是原子晶体,熔化时破坏共价键;碘是分子晶体,升华时粒子间克服分子间作用力;故答案为:离子键;共价键;分子间作用力;
(2)由极性键形成的非极性分子有CO2,由非极性键形成的非极性分子有H2,能形成分子晶体的物质是H2、CO2、HF,含有氢键的晶体的化学式是 HF,属于离子晶体的是(NH4)2SO4,属于原子晶体的是SiC,五种物质的熔点由高到低的顺序是 SiC>(NH4)2SO4>HF>CO2>H2,故答案为:CO2;H2;H2、CO2、HF;HF;(NH4)2SO4;SiC;SiC>(NH4)2SO4>HF>CO2>H2;
(3)根据晶体的物理性质分析,
A.固态时能导电,能溶于盐酸,属于金属晶体;
B.能溶于CS2,不溶于水,属于分子晶体;
C.固态时不导电,液态时能导电,可溶于水,属于离子晶体;
D.固态、液态时均不导电,熔点为3 500℃,属于原子晶体;
故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(4)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石,故答案为:氯化铯;氯化钠;二氧化硅;金刚石;

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案