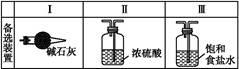
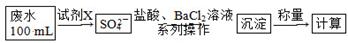题目内容
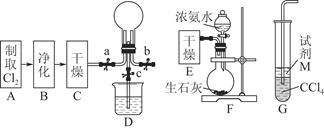
如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选择,必要时可重复选用。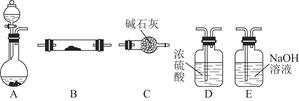
请回答下列问题:
(1)在装置A的圆底烧瓶中装入锌片,分液漏斗中装入稀硫酸,以验证H2的还原性并检验其氧化产物。
①若按顺序A→D→B→B→C连接时,则两次使用的装置B中所盛放药品的化学式依次为CuO、 (填化学式)。
②检验装置的气密性后,在加热装有CuO的装置B前必须进行的操作是 。
(2)在装置A的锥形瓶中装入Na2O2,分液漏斗中装入浓氨水,装置B中装入固体催化剂,以进行氨的催化氧化。
①若装置的连接顺序为A→C→B→C,则装置B中氨的催化氧化反应的化学方程式为 ,装置B中可能观察到的现象是 。
②若把装置A制得的气体与Cl2混合在一起,产生白烟,写出反应的化学方程式 。该反应体现了氨的 性。
(1)①CuSO4 ②检验H2的纯度
(2)①4NH3+5O2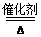 4NO+6H2O 有红棕色气体生成
4NO+6H2O 有红棕色气体生成
②8NH3+3Cl2=N2+6NH4Cl 还原性
解析

新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得结论出 |
| 氯水中何种物质能使湿润的红色布条退色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ① ② ③ ④H2O使布条退色 | ①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色 实实验②: ; 实验③:把红色布条放在水里,布条不退色 | |
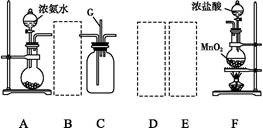
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: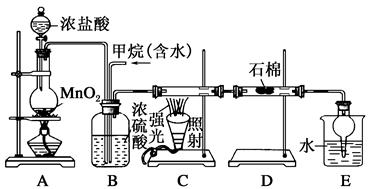
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③______________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是____________。
(4)E装置的作用是________(填序号)。
| A.收集气体 | B.吸收氯气 |
| C.防止倒吸 | D.吸收氯化氢 |
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填序号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
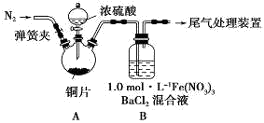
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的最佳物质的量之比为________ ;为了吸收该反应中产生的尾气,可选择的最佳装置是________(填序号)。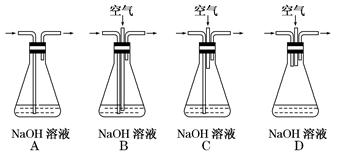
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计。
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再使氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与烯硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部转化为Fe(OH)3沉淀(一般当铁离子的浓度下降到10-5mol·L-1时,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:常温下,Ksp[Cu(OH)2]=10-22,Ksp[Fe(OH)3]=10-38)
请回答下列问题:
①方案1中仪器N的名称是________。
②方案2中为了使铁元素全部沉淀,应调节pH至少为________。
③方案2中甲物质可选用________(填序号)。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E.Fe2(SO4)3 |
某兴趣小组设计如下图实验装置进行实验。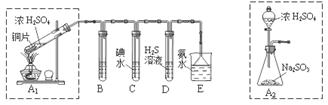
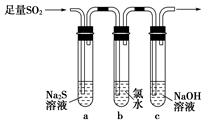
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分: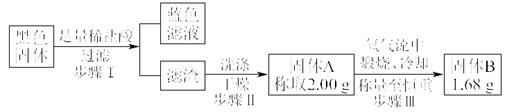
(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则“吸收液” 中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |