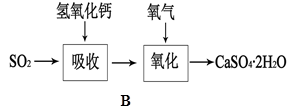
题目内容
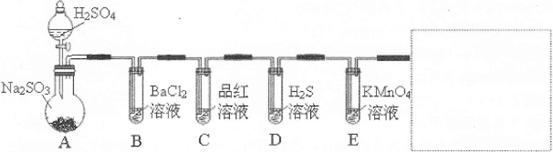
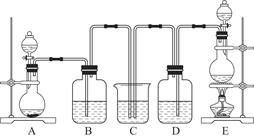
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。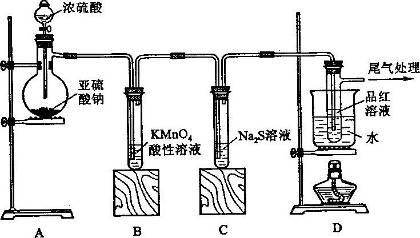
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式_______________________;
(2)实验过程中,装置B、C中发生的现象分别是____________、___________,装置B中发生反应的离子方程式为_________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________;
(4)尾气可采用___________________溶液吸收。
(1)蒸馏烧瓶 Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O
(2)溶液由紫红色变为无色 无色溶液中出现黄色浑浊 5SO2 + 2MnO4-+ 2H2O= 2Mn2+ + 5SO42- + 4H+
(3)品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热,溶液又恢复为红色。
(4)NaOH
解析试题分析:(1)在蒸馏烧瓶中发生反应的化学方程式为Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑+ H2O.(2)实验过程中,装置A是制取SO2气体,B是验证SO2气体的还原性,现象是KMnO4紫色溶液变浅或褪色,发生反应的离子方程式为5SO2 + 2MnO4-+ 2H2O= 2Mn2+ + 5SO42- + 4H+;C验证SO2气体的氧化性,现象是产生淡黄色沉淀。(3)装置D的目的是探究SO2与品红作用的可逆性,实验操作及现象是通入SO2气体,品红溶液褪色,然后关闭分液漏斗旋塞,点燃酒精灯加热,溶液又恢复为红色。就证明了SO2气体的漂白是不稳定的。(4)因为SO2气体是酸性气体,能与NaOH溶液发生反应,所以尾气可采用通入到NaOH溶液的方法来处理。
考点:考查SO2气体实验室制法、性质的检验、尾气的处理的知识。

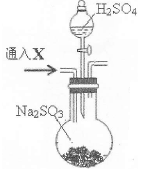
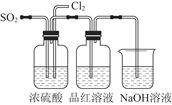
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。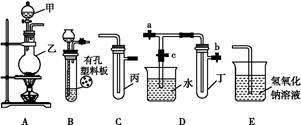
请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
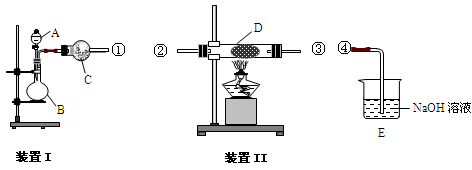
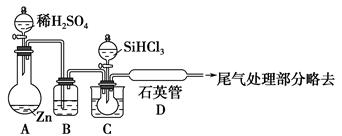
 SiHCl3+H2
SiHCl3+H2