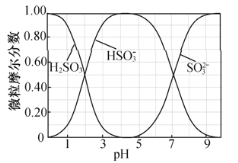
题目内容
【题目】CO2与人们的日常生活、生产和科学研究密不可分,综合利用CO2是解决能源问题的有效途径之一。回答下列问题:
(1)用CaSO4代替O2与燃料CO反应,能得到较纯的CO2,有关反应如下:
①CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) ΔH1=-189.2kJmol-1(主反应)
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5kJmol-1(副反应)
③CO(g)=![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2kJmol-1(副反应)
CO2(g) ΔH3=-86.2kJmol-1(副反应)
则反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=___。
(2)已知CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH。向一密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)=0.2molL-1,c(H2)=0.8molL-1,c(H2O)=1.6molL-1。若200℃时该反应的平衡常数K=64.8,则该反应的ΔH___(填“>”或“<”)0。
(3)一定条件下,CO2还可以转化为低碳烯烃,反应的化学方程式为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH,在两个容积均为2L的恒容密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。

①x___(填“>”“<”或“=”)2.0。
②若起始加入的CO2、H2的物质的量分别为1mol和2mol,则P点时的平衡常数K=___。
③比较P点和Q点的化学平衡常数:Kp___(填“>”“<”或“=”)KQ,理由是___。
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。

①a极发生___(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为___。
【答案】-151.1kJmol-1 < > 512 < 由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,则KP<KQ 氧化 2CO2+12H++12e-=C2H4+4H2O
【解析】
(1)根据盖斯定律进行计算;
(2)根据300℃时反应达到平衡时各物质的浓度计算平衡常数;根据温度升高,平衡左移判定反应的H;
![]() 相同条件下,两种物质参加反应,增加该物质浓度,另外一种物质转化率增大;
相同条件下,两种物质参加反应,增加该物质浓度,另外一种物质转化率增大;
![]() 由图可知,P点的二氧化碳转化率为
由图可知,P点的二氧化碳转化率为![]() ,根据三段式进行平衡常数的计算;
,根据三段式进行平衡常数的计算;
![]() 由图可知,该反应为放热反应,升高温度,化学平衡向左移动,据此判断K值变化;
由图可知,该反应为放热反应,升高温度,化学平衡向左移动,据此判断K值变化;
![]() 电解池中,阳极发生氧化反应,由a极产生氧气可知,a极发生的是氧化反应;
电解池中,阳极发生氧化反应,由a极产生氧气可知,a极发生的是氧化反应;
![]() 极上生成乙烯为还原反应。
极上生成乙烯为还原反应。
![]() 由盖斯定律可可知,
由盖斯定律可可知,![]()
![]() 可得:2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g) ΔH=-151.1kJmol-1;
可得:2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g) ΔH=-151.1kJmol-1;
故答案为:-151.1kJmol-1;
(2)由在300℃时发生上述反应,达到平衡时测得c(CO2)=0.2molL-1,c(H2)=0.8molL-1,c(H2O)=1.6molL-1反应方程式和达到平衡时可知,平衡时c(CH4)=0.8molL-1,则300℃时,平衡常数为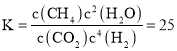 ,若200℃时该反应的平衡常数
,若200℃时该反应的平衡常数![]() ,则说明温度升高,平衡逆向移动,该反应为放热反应,
,则说明温度升高,平衡逆向移动,该反应为放热反应,![]() ;
;
故答案为:![]() 。
。
![]() 相同条件下,氢气的物质的量浓度越大,二氧化碳的转化率越大,故
相同条件下,氢气的物质的量浓度越大,二氧化碳的转化率越大,故![]() ;
;
故答案为:![]() 。
。
![]() 由图可知,P点的二氧化碳转化率为
由图可知,P点的二氧化碳转化率为![]() ;
;
![]()
![]()
起始![]() : 1 2 0 0
: 1 2 0 0
变化![]() :
: ![]()
![]()
![]() 1
1
平衡![]() :
: ![]()
![]()
![]() 1
1
平衡![]() :
:![]()
![]()
![]()
![]()
平衡常数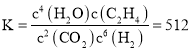 ;
;
故答案为:512;
![]() 由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,所以
由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,所以![]() 。
。
故答案为:![]() ;由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,则
;由图可知,该反应为放热反应,升高温度,化学平衡向左移动,K值减小,则![]() 。
。
![]() 由a极产生氧气可知,a极发生的是氧化反应;
由a极产生氧气可知,a极发生的是氧化反应;
故答案为:氧化;
![]() 极上生成乙烯的电极反应为
极上生成乙烯的电极反应为![]() ;
;
故答案为:![]() 。
。

 应用题作业本系列答案
应用题作业本系列答案【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
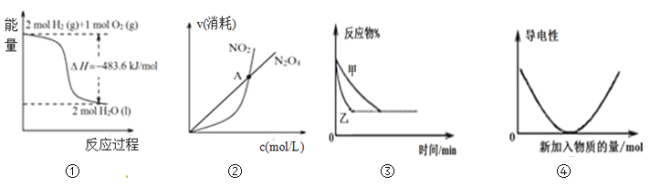
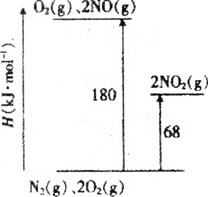
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。
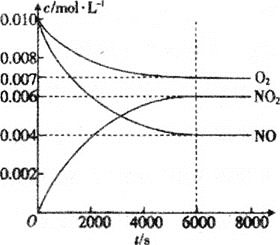
①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。